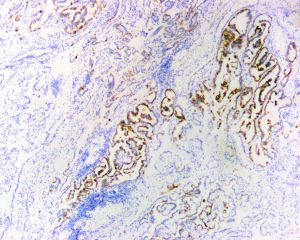
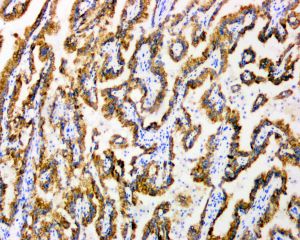
几乎全部阳性(≥95%的病例阳性):
AE1、CAM 5.2、N-cadherin、CD15、CK18、IGF-1R、PAX8通常阳性(<95%,≥75%的病例阳性):
P504s、CK8、p-S6RP、RCC、CK7、NAPSIN-A经常阳性(<75%,≥55%的病例阳性):
CAIX、EMA、CK19、EpCAM、Vimentin、CD7有时阳性(<55%,≥35%的病例阳性):
CA9、PTEN、CD10、GST-alpha、Podoplanin少数阳性(<35%,≥15%的病例阳性):
34bE12、SATB2、CK5/6、E-cadherin、PAX2偶尔阳性(<15%,≥5%的病例阳性):
GLUT1、PSMA、CD117、CD57、Galectin-3、WT-1、Calretinin几乎全部阴性(<5%的病例阳性):
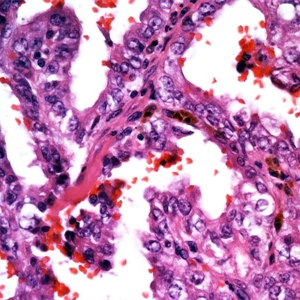
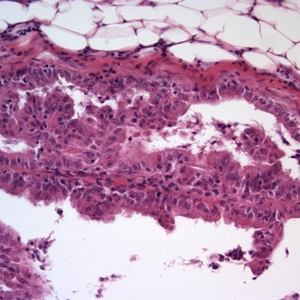
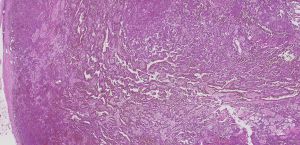
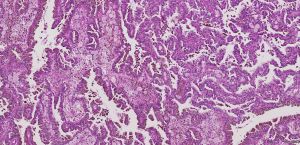
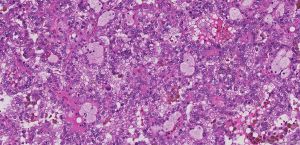
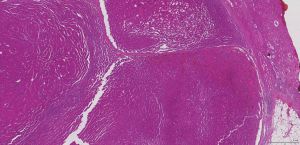
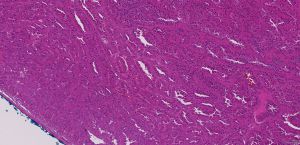
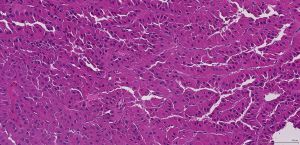
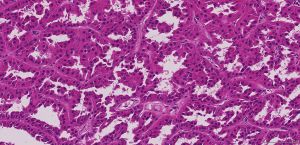
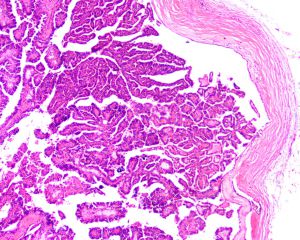
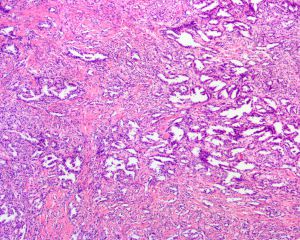
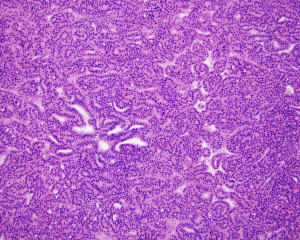
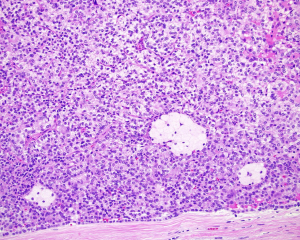
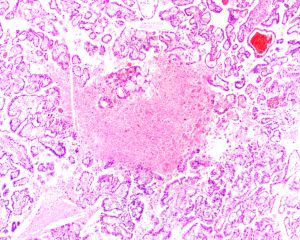
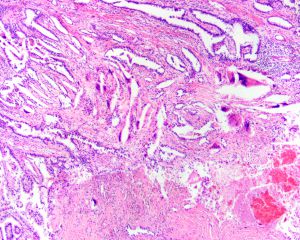
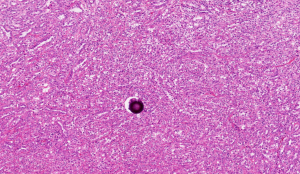
BCL-2、Cathepsin-K、CK13、FLI-1、GATA3、Hep-Par1、Lewis-Y、mdm2、Mesothelin、MITF、OCT4、P53、TAG72、Thrombomodulin、CEA-P、Arginase-1、CD56、CDX-2、CK14、CK17、CK20、PAX5、SALL4、TFE3、TTF-1、TRPS12.镜下可见由具纤细的纤维血管轴心的乳头状结构及管状结构构成,纤维血管轴心可有泡沫状巨噬细胞、胆固醇结晶和砂粒体,偶尔纤维血管轴心因水肿或玻璃样变纤维组织而增宽;
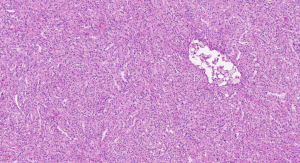
3.部分可见肾小球样结构、微结节类似于顿挫的乳头状结构,部分病例以管状结构为主,或乳头拥挤似实性结构;
4.其他类型的肾细胞癌如MiT家族易位肾细胞癌、遗传性平滑肌瘤病肾细胞癌综合征相关性肾细胞癌、集合管癌、黏液性管状和梭形细胞癌等亦可显示局部的乳头状结构,但存在其他组织学特征以及不同的免疫表型和分子遗传学特点(见鉴别诊断);
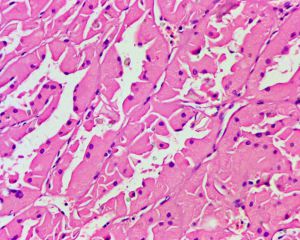
5.常见出血和坏死,巨噬细胞内、间质和肿瘤细胞浆内可有含铁血黄素;
6.乳头状肾细胞癌有两种类型,部分病例可兼具两种形态特征:
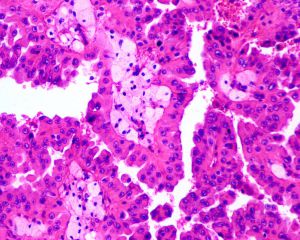
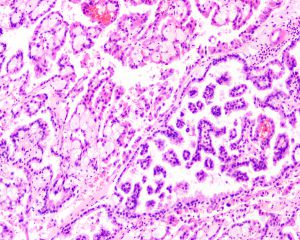
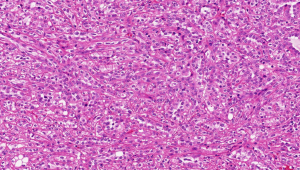
1型:乳头表面被覆小的立方状细胞,胞浆稀少嗜碱性,部分可表现为透明胞浆,单层排列,该型者多灶性病变常见;
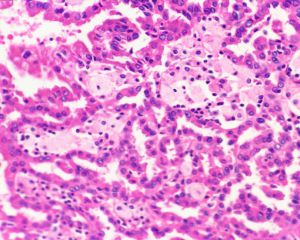
2型:被覆瘤细胞呈假复层排列,胞浆丰富嗜酸性,核级别高可见明显的核仁;
7.部分肿瘤具有丰富的分布均匀的细颗粒状嗜酸性胞浆,核低级别,呈单层线性朝向乳头表面或管状结构的腔面分布,呈嗜酸细胞瘤样,又称为嗜酸细胞性乳头状癌;局部可见明显的淋巴样间质浸润,组织学类似于Warthin瘤,又称为Warthin瘤样乳头状肾细胞癌;
8. 部分I型乳头状肾细胞癌可伴有低级别的实性梭形细胞灶,类似于肉瘤样转化,但缺乏细胞的异型性和核分裂象以及坏死等特征。
MiTF易位相关性肾细胞癌:主要是TFE3易位相关性肾细胞癌,患者年龄较轻,乳头被覆通常由胞浆丰富的嗜酸性瘤细胞和透明细胞混合而成,常见砂粒体钙化但罕见乳头轴心的泡沫样细胞聚集,免疫组化染色特征性的弥漫核表达TFE3,表达Cathepsin-k,遗传学上存在TFE3基因重排;
FH缺陷型肾细胞癌(FH-RCC)和遗传性平滑肌瘤病和肾细胞癌综合征相关性肾细胞癌(HLCRCC-RCC):两者均与FH基因突变有关,前者为体细胞突变,后者为胚系突变,常伴随皮肤或子宫的多发性平滑肌瘤病,乳头结构被覆高级别嗜酸性瘤细胞类似于2型乳头状肾细胞癌,但瘤细胞具有特征性的嗜酸性包涵体样核仁和核仁周空晕,除了乳头状结构之外常见其他侵袭性的结构特征如肉瘤样结构、管囊状结构以及筛状结构等,免疫组化染色显示FH表达缺失,过表达2SC;
管囊状肾细胞癌:可伴有少量的乳头状结构,但以扩张的小管和微囊结构为主,被覆高核级别的立方状或鞋钉样嗜酸性瘤细胞,免疫组化染色常表达34be12,较少表达CK7;
集合管癌:肿瘤的中心位于集合管,边界不清,呈弥漫的浸润性生长和促结缔组织增生的间质反应,无乳头状癌常见的包膜,乳头通常被覆鞋钉样瘤细胞;
透明细胞乳头状肾细胞癌:以透明细胞为主,可见特征性的类似于分泌性子宫内膜腺体的一致性核下空泡状结构,免疫组化染色杯口状表达CAIX,不表达AMACR;
透明细胞肾细胞癌伴有乳头状结构:乳头结构较局灶,背景为典型的透明细胞肾细胞癌结构,免疫组化染色弥漫膜表达CAIX;较少表达CK7
黏液小管状和梭形细胞肾细胞癌:可与1型乳头状肾细胞癌伴有低级别梭形细胞灶混淆,但黏液小管和梭形细胞肾细胞癌可见间质不同程度的黏液变性,免疫组化染色两者存在明显的重叠,黏液小管和梭形细胞癌无7和17号染色体三体性和Y染色体丢失;
后肾腺瘤:无纤维性包膜,以致密的小管状结构为主,瘤细胞胞浆较1型乳头状肾细胞癌稀少,核更深蓝,无间质泡沫细胞聚集,免疫组化染色表达Cadherin-17和CD57和WT1,遗传学上存在BRAFV600E突变;
上皮为主型肾母细胞瘤:可以实体性1型乳头状肾细胞癌混淆,瘤细胞更幼稚,呈柱状垂直于乳头生长,核分裂象较多,罕见间质泡沫细胞聚集,至少局灶可见不成熟的胚芽结构,免疫组化染色弥漫表达WT1;
嗜酸细胞腺瘤:可与嗜酸细胞乳头状肾细胞癌混淆,嗜酸细胞腺瘤无真性的乳头状结构形成,免疫组化染色不或仅局灶表达CK7,膜表达CD117;
Genital Organs (Chapter 1). Geneva, Switzerland: WHO Press, World Health Organization; 2016:23–25.
Amin MB, Corless CL, Renshaw AA, et al. Papillary (chromophil) renal cell carcinoma: histomorphologic characteristics
and evaluation of conventional pathologic prognostic parameters in 62 cases. Am J Surg Pathol. 1997;21:621–635.
Delahunt B, Eble JN. Papillary renal cell carcinoma: a clinicopathologic and immunohistochemical study of 105 tumors. Mod Pathol. 1997;10:537–544.
Argani P, Netto GJ, Parwani AV. Papillary renal cell carcinoma with low-grade spindle cell foci: a mimic of mucinous tubular and spindle cell carcinoma. Am J Surg Pathol. 2008;32:1353–1359.
Ren Q, Wang L, Al-Ahmadie HA, et al. Distinct genomic copy number alterations distinguish mucinous tubular and spindle cell carcinoma of the kidney from papillary renal cell carcinoma with overlapping histologic features. Am J Surg Pathol. 2018; 42:767-777.
Mantoan Padilha M, Billis A, Allende D, et al. Metanephric adenoma and solid variant of papillary renal cell carcinoma: common and distinctive features. Histopathology. 2013;62:941–953.
Skenderi F, Ulamec M, Vanecek T, et al. Warthin-like papillary renal cell carcinoma: morphologic, immunohistochemical and molecular genetic analysis of 11 cases. Ann Diagn Pathol. 2017;27:48–56.
Ohe C, Smith SC, Sirohi D, et al. Reappraisal of morphologic differences between renal medullary carcinoma, collecting duct carcinoma, and fumarate hydratase-deficient renal cell carcinoma. Am J Surg Pathol. 2018;42:279–292.