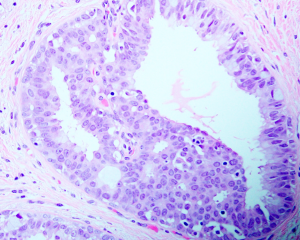
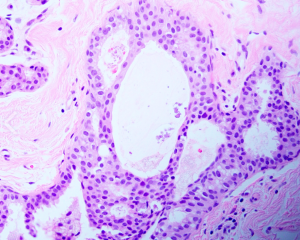
1. 发病高峰年龄为45岁左右,因为X线发现乳腺微小钙化而进行的活检中10-20%出现ADH,不形成肉眼可见的明显的病变。
2. 组织学结构:ADH是腺细胞的增生,累及终末导管小叶单位;一般为单灶分布或累及很小的区域,如果是多灶分布,则灶和灶之间细胞形态是不同的,说明其多克隆性。ADH诊断包括质的标准和量的标准。
3. 1)质的标准包括:
(1)结构特征: 最常见的是筛状结构和拱形的细胞桥,形成的孔的不像导管内癌中看到的那么一致;筛状结构空隙之间彼此连接的细胞桥可以窄并且可以显示流水样排列;微乳头结构可以存在,但是不广泛;常常和柱状细胞改变相关;局灶坏死罕见。
(2)细胞学特征:所有的细胞都是腺细胞,缺乏CK5/6的表达;通常表现为部分细胞的一致性;细胞界限清楚,彼此分离;可以存在不同形态学特征的细胞(如立方的、梭形的、柱状的);单一形态的细胞可以和UDH的细胞混合存在;不应该看到高级别的核。
2)量的标准包括:
当质的标准相同,将ADH从低级别DSIS中区别开来的标准一般有两个:一是至少2个导管受累,另一个是受累导管尺寸累计>2mm认为是低级别DCIS;对于高级别的DCIS则没有大小的要求。
1. UDH
UDH是非克隆性的腔细胞、肌上皮细胞和中间型细胞的混合性增生。细胞可以是上皮样的、梭形的或柱状的等多种细胞形态,大小不一,排列拥挤、紊乱、重叠,经常表现为流水样或旋涡状生长模式,可以见到大汗腺化生、透明细胞改变或柱状细胞改变;在结构上,经常看到受累导管呈实性,如果出现腔隙,腔隙往往位于导管周边,而且不规则,类似血栓再通的腔隙,细胞也不围绕着腔隙周围排列,如果出现乳头,则乳头底部宽阔,顶端狭窄;高分子量细胞角蛋白CK5/6为混合性或马赛克样染色模式,ER阳性,但常常是不均匀分布且染色强度不等。
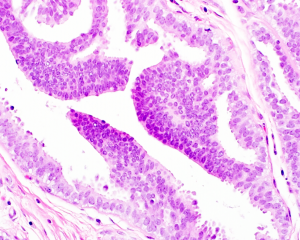
2. 低级别DCIS
单一形态的腔细胞充满导管管腔并使管腔扩张。细胞形态单一、彼此分离、不重叠,细胞呈立方形,筛状结构或拱形结构中的细胞桥看上去僵硬,筛状空隙的在三维结构上是球形的,可以形成微乳头、乳头、筛状或实性等复杂的排列模式,细胞大小、形状一致,分布均匀,细胞核具有极向性,朝向腔面,通常累及多个导管管腔,弥漫分布,很少在大小上< 2-3 mm,可以与ADH或低级别浸润性癌共同存在。
3. 胶原小球病(Collagenous spherulosis ,CS)
有些CS病例因为可以形成筛状腔隙可以类似ADH。低倍镜下,小球和细胞排列会让人产生筛状增生的表现,腔隙充满AB/PAS(+)的基底膜样物质,免疫组化可以证实肌上皮细胞衬附于假腺腔样结构,而在ADH中,肌上皮细胞只在导管周围分布。在非常少见的病例,可以看到小叶瘤变累及CS,肿瘤性小叶细胞代替了固有的腔细胞,保留肌上皮细胞和腔内小球,可以表现细胞形态单一,很难与ADH或LGDCIS区别,基底膜样物质的存在及小叶细胞彼此缺乏黏附性的特征可以帮助鉴别,E-cadherin和肌上皮细胞免疫组化染色可以明确两种细胞类型(小叶细胞和肌上皮细胞)。
Schnitt: Biopsy Interpretation of the Breast, 3rd Edition, 2018
Lopez-Garcia MA, Geyer FC, Lacroix-Triki M, Marchió C, Reis-Filho JS. Breast cancer precursors revisited: molecular features and progression pathways. Histopathology. 2010 Aug;57(2):171-92.
East EG, Carter CS, Kleer CG. Atypical Ductal Lesions of the Breast: Criteria, Significance, and Laboratory Updates. Arch Pathol Lab Med. 2018 Oct;142(10):1182-1185.