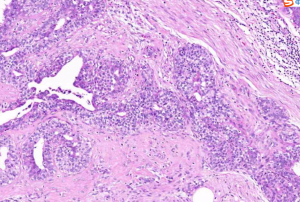
1. ALH常发生于绝经前妇女,高峰年龄为45岁,在不伴有浸润性癌的ADH和LCIS只占到乳腺活检的0.5-4.0%。ADH常常双侧发生,可以是多中心的病变,没有临床症状和影像学特征,不形成可触及的肿块,经常是由于钙化而非肿物进行乳腺活检时偶然发现。
2. 组织学特征:
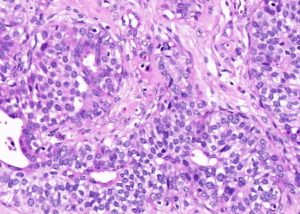
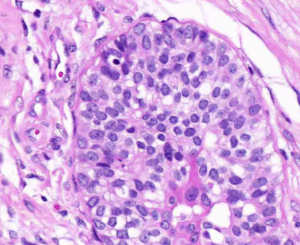
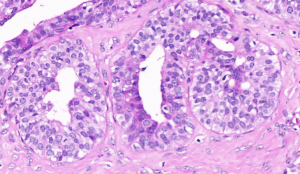
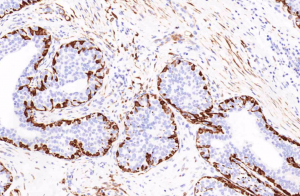
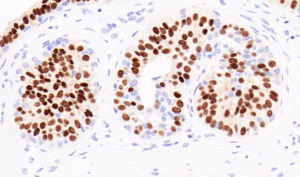
2.1 结构特征:细胞失去黏附性,规则分布,填充于终末导管小叶单位的腺泡并使其轻度扩张,整个小叶结构保留;细胞彼此分散,不形成筛状、微乳头或拱形结构;一般不伴有钙化或坏死。
2.2 细胞学特征:可见两种类型的细胞,两种细胞可单独存在,也可混合存在
2.2.1 A型细胞指小的、温和的形态一致的细胞,胞浆少,核圆形,仅轻度正大,大小相当于淋巴细胞核的1-1.5倍,核仁不明显;
2.2.2 B型细胞胞质更多,核大小不一,相当于淋巴细胞核的2倍大小,核仁明显
2.2.3 区分A型和B型细胞临床意义不明确,有时可见胞质内空泡,类似印戒细胞,黏液染色阳性,但对小叶性肿瘤无特征性。
2.3 相邻组织经常有钙化,可以伴有大汗腺囊肿、柱状细胞变、扁平上皮不典型增生以及ADH等病变;
2.4 LN病变沿着终末导管派杰样扩散是一种常见的表现,派杰样扩散是指病变细胞位于基底膜和表面正常的上皮细胞之间,在大的导管可以形成三叶草形外观,与导管内突出的肌上皮细胞及组织细胞可以很难鉴别。
2.5 除了位于小叶内,可以累及许多其它病变,包括硬化性腺病、放射状瘢痕、乳头状病变 、纤维腺瘤以及胶原小体病,这时肌上皮及E-钙黏附素免疫组化染色有助于诊断。
1. LCIS:ALH与LCIS的区别是基于病变程度的不同,至少有1/2的乳腺小叶单位受累的时候诊断LCIS,因为病变的连续性,有时候很难区分。有些专家喜欢使用包括了ALH和LCIS两种病变的LN名称,但是许多研究发现诊断为LCIS的病人以后发展成浸润性癌的风险比诊断为ALH的病人高。
2. 伴有低级别核的实性型DCIS:单纯依靠形态学将LN与实性低级别DCIS区别开是困难的。具有二级管腔形成或形菊形团样细胞排列或细胞具有黏附性提示是导管病变,而非LN。在诊断困难的病例,E-cadherin免疫组化染色是有帮助的,在LN缺乏膜阳性,而DCIS显示膜阳性,需要仔细观察形态学及免疫组化染色结果从而做出正确判断,残存的正常导管上皮细胞(E-cadherin+)可以和肿瘤性的小叶细胞(E-cadherin-)混合存在,LN 和 DCIS也可以共同存在于同一个导管或小叶。
3. 组织保存不佳或破碎的人工假象:可能给人以细胞缺乏黏附性的假象,通常会累及受影响区域的所有细胞,其免疫组化标记结果不可靠,仔细注意的形态学和细胞学质量可以帮助做出正确的判断。
4. 肌上皮细胞增生:由于月经周期或化生性改变可以变得更突出,与ALH的细胞相比,肌上皮细胞的核更小、更圆,染色更深,胞浆可以透明,而ALH的胞浆一般是嗜酸性的;可以类似ALH的派杰样播散,但是肌上皮细胞之间没有失去黏附性,细胞之间彼此分离的空隙看不到,肌上皮细胞标记物免疫组化染色是有帮助的。
5. 导管内组织细胞的浸润:组织细胞可以存在于慢性炎症周围的导管上皮中,胞浆透明而且缺失细胞黏附性类似LN。主要区别有:组织细胞通常散在分布,LN通常表现为绳索状或巢状分布;组织细胞胞浆丰富、泡沫状,而LN细胞胞浆常常一致、深染;组织细胞的和常常不规则、有折叠,而LN的细胞核往往是一致圆形。
诊断ALH的病人以后发展为浸润性癌的相对危险性是4-5倍,每年约1%的病人进展为浸润性癌,随着时间的增加,发病率有增高的趋势,25年内进展为浸润性癌的概率达30%。年轻患者,伴有钙化的患者进展为浸润性癌的风险相对更高,预防性化疗可降低进展为浸润性癌的风险。
Muller KE, Roberts E, Zhao L, Jorns JM. Isolated Atypical Lobular Hyperplasia Diagnosed on Breast Biopsy: Low Upgrade Rate on Subsequent Excision With Long-Term Follow-up. Arch Pathol Lab Med. 2018;142(3):391‐395.
Gregory KJ, Roberts AL, Conlon EM, et al. Gene expression signature of atypical breast hyperplasia and regulation by SFRP1. Breast Cancer Res. 2019;21(1):76.
Nonni A, Zagouri F, Sergentanis TN, Lazaris AC, Patsouris ES, Zografos GC. Immunohistochemical expression of estrogen receptors alpha and beta in lobular neoplasia. Virchows Arch. 2007;451(5):893‐897.
Jorns J, Sabel MS, Pang JC. Lobular neoplasia: morphology and management. Arch Pathol Lab Med. 2014;138(10):1344‐1349.
WHO 乳腺肿瘤分类,2019,第五版