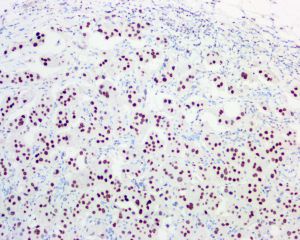
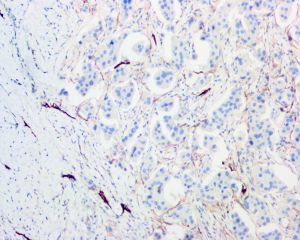
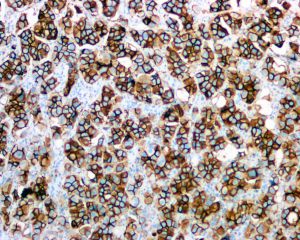
几乎全部阳性(≥95%的病例阳性):
AE1/AE3、EMA、E-cadherin通常阳性(<95%,≥75%的病例阳性):
CD95-fas、CD95L-FasL、CK7经常阳性(<75%,≥55%的病例阳性):
androgen receptor、HER2、P53有时阳性(<55%,≥35%的病例阳性):
GCDFP-15少数阳性(<35%,≥15%的病例阳性):
PRP、S100偶尔阳性(<15%,≥5%的病例阳性):
Cathepsin-K几乎全部阴性(<5%的病例阳性):
adipophilin、Collagen IV、FVIII、FVIIIRAg、ULEX - 1、CD117、CD31、CK20、CK5、Podoplanin1.大体表现和一般的乳腺浸润性癌相同,常见于老年病人,平均发病年龄是55岁。
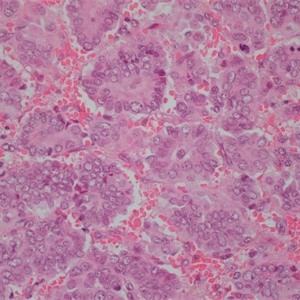
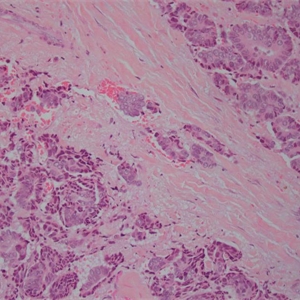
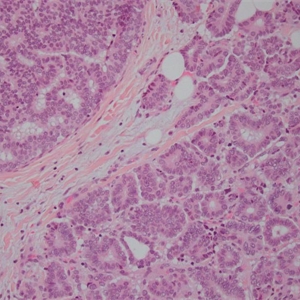
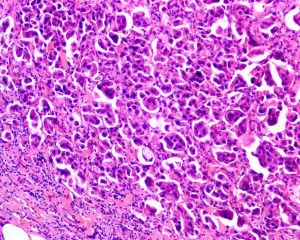
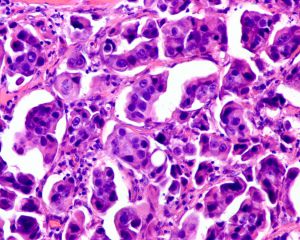
2.称其为“微乳头”可能是错误的,因为其缺乏纤维血管轴心,肿瘤可能是以一种中央带有空腔的细胞球的方式生长,细胞簇中央往往可以见到空腔结构,有些是实性的,1个或几个肿瘤细胞簇似乎悬浮于中空的区域内,细胞簇之间为稀疏的纤维胶原,有时很难与脉管累犯鉴别。低倍镜下图像类似于秋天的落叶或海绵状。
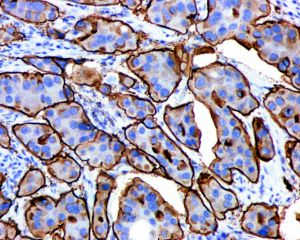
3.微乳头中的细胞呈特殊的“极性倒置”的排列方式,即细胞分泌顶端向外的细胞排列方式。EMA(MUC 1)免疫组化染色显示肿瘤细胞簇外周阳性。
4.肿瘤细胞多具有中级别或高级别的细胞核异型,核多形性、浓染以及大核仁,胞浆丰富、嗜酸性、均匀的颗粒样或空泡样。
5.多数浸润性微乳头状癌同时伴有非特殊性浸润性导管癌或其他类型浸润性癌,此时应该报告微乳头癌所占比例,只有当微乳头结构占比>90%以上时才能报告(纯)浸润性微乳头癌。
6.浸润性微乳头癌可以伴随微乳头型或筛状型DCIS,而且伴随的DCIS通常具有高级别核。
7. 1/3-2/3的浸润性微乳头癌会发生淋巴-血管浸润,具有较高的淋巴结转移率,只有在远离肿瘤主体的区域才能诊断为淋巴-血管浸润。
8.在进行浸润性癌分级时,中央有空腔的细胞簇不应该认为是分级中的腺管状结构,在腺管形成的分级中应该定义为3分。在穿刺活检标本中发现微乳头状癌高度提示存在淋巴结的转移性癌。
9.在一些乳腺黏液性癌,漂浮在黏液中的肿瘤细胞团形态学与浸润性微乳头状癌相似,不应诊视为浸润性微乳头状癌成分。
1.转移性微乳头状癌:
转移到乳腺的微乳头状癌很少见,卵巢/腹膜浆液性乳头状癌,肺/膀胱微乳头状癌形态上可能类似于乳腺的浸润性微乳头状癌。大多数浸润性微乳头状癌同时伴有筛孔状,或导管内乳头状癌成分;ER、PR染色可能帮助鉴别乳腺/妇科肿瘤与其他一些部位的肿瘤的鉴别。妇科浆液性肿瘤PAX8阳性,而乳腺癌PAX8阴性。需要注意的是,膀胱微乳头状癌和乳腺微乳头状癌均可表达GATA3,单纯应用该标志物无助于两者的诊断。
2.具有组织收缩间隙的非特殊性浸润性导管癌:
无微乳头状癌细胞的极性颠倒现象。免疫组织化学染色浸润性微乳头状癌细胞团周缘MUC1、EMA线性强阳性,而非特殊性浸润性导管癌则为细胞四周均匀散布的MUC1、EMA阳性。
Acs G, Paragh G, Chuang ST, Laronga C, Zhang PJ. The presence of micropapillary features and retraction artifact in core needle biopsy material predicts lymph node metastasis in breast carcinoma. Am J Surg Pathol. 2009;33(2):202‐210.
Nassar H. Carcinomas with micropapillary morphology: clinical significance and current concepts. Adv Anat Pathol. 2004;11(6):297‐303.
Nassar H, Pansare V, Zhang H, et al. Pathogenesis of invasive micropapillary carcinoma: role of MUC1 glycoprotein. Mod Pathol. 2004;17(9):1045‐1050.
Guo X, Chen L, Lang R, Fan Y, Zhang X, Fu L. Invasive micropapillary carcinoma of the breast: association of pathologic features with lymph node metastasis. Am J Clin Pathol. 2006;126(5):740‐746.
WHO 乳腺肿瘤分类,2019,第五版