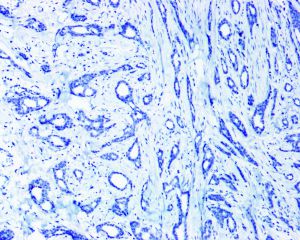
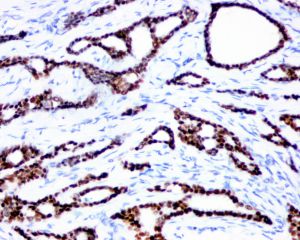
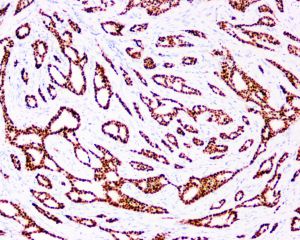
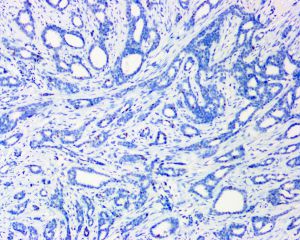
几乎全部阳性(≥95%的病例阳性):
Alpha-Catenin、Beta-catenin、CAM 5.2、ER、PRP、CK18、CK19通常阳性(<95%,≥75%的病例阳性):
androgen receptor经常阳性(<75%,≥55%的病例阳性):
EpCAM少数阳性(<35%,≥15%的病例阳性):
34bE12、HER2、E-cadherin、S100偶尔阳性(<15%,≥5%的病例阳性):
BRCA1几乎全部阴性(<5%的病例阳性):
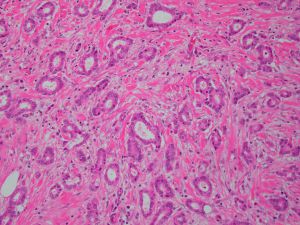
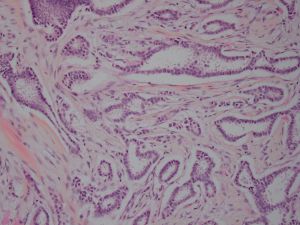
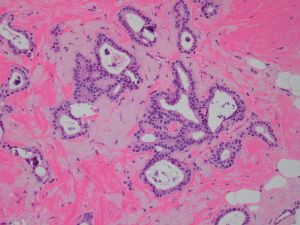
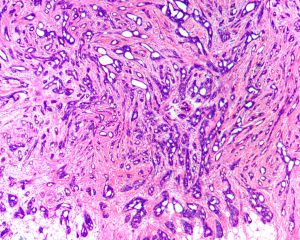
Collagen IV、FLI-1、OCT4、P53、P63、TAG72、CK14、CK5/6、GCDFP-15、Vimentin、SMA、TTF-11. 95%的病例肿瘤大小<2cm,大部分是<1cm,20%-55%可为多灶多中心性发生;
2. 低倍镜下病变常呈星芒状,杂乱无序的小管在小叶间或小叶内呈浸润性生长;
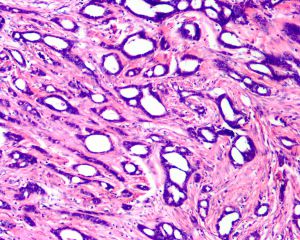
3. 最少90%的区域由分化好的小管构成,小管小-中等大小,圆形、卵圆形或成角状(即小管的一头较尖,似泪滴状、船头形、长管状和带棱角的管状),管腔开放,其内少有分泌物及钙化;
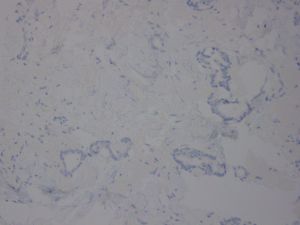
4. 小管被覆单层上皮,多数小管无完整的基膜层;
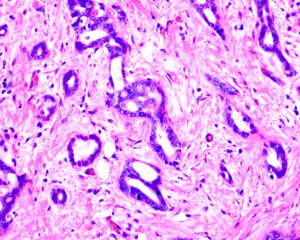
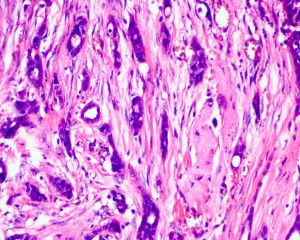
5. 腺上皮细胞呈立方或低柱状,轻度增大,胞质呈双嗜性,约1/3病例有胞突;
6. 最少90%的细胞为低级别核型,无高级别核型;胞核位于细胞近基底膜端1/2-1/3,呈圆形或卵圆形,染色质细腻,核仁小或不明显,核分裂像罕见;
7. 无片状及多层细胞增生;
8. 小管周围常见纤维组织增生,亦可见有较多弹力纤维或胶原纤维;
9.多数病例伴有柱状细胞变、平坦上皮不典型增生、低级别导管原位癌(筛状或微乳头型),偶见小叶瘤变、放射性硬化性病变等。
1.硬化性腺病:
硬化性腺病与小管癌的区别在于它具有小叶结构轮廓,腺体明显受压、变形。硬化性腺病存在肌上皮细胞,可通过免疫染色显示。同样,硬化性腺病完整的基底膜可以用IV型胶原和层粘连蛋白免疫染色显示。
2.复杂硬化性病变/放射状瘢痕:
复杂性硬化性腺病/放射状瘢痕周围呈不规则放射状组织排列比癌组织周围是不规则放射状排列要长,其中央纤维化区域和贪婪纤维变性区域包含少量小且变形的小管结构可以类似小管癌,但是小管周围肌上皮存在,而且一般都局限在中央纤维化的区域。在少数放射状瘢痕病例中,特别是在纤维化明显的区域,肌上皮染色变弱或局灶缺失。放射状瘢痕周围的腺管结构不同程度地扩张,伴有导管上皮增生。
3.微腺性腺病:
微腺性腺病表现为结节或弥漫的排列方式,很少或没有促结缔组织增生反应,腺腔小、一致且圆形;腺腔内可见嗜酸性分泌物,缺乏小管癌中的顶浆分泌;缺乏肌上皮细胞存在;免疫组化强表达S100,但是ER/PR阴性。
4.低级别腺鳞癌:
低级别腺鳞癌形态表现为小的、呈逗点状的腺管或实性巢,局灶可见鳞状分化,鳞状分化部分P63阳性,肿瘤组织ER、PR阴性。
5.小管-小叶癌
小管-小叶具有典型的小叶癌成分,而小管癌缺乏小叶癌成分。
6.Ⅰ级非特殊型浸润性癌:
小管癌不是Ⅰ级非特殊型浸润性癌的同义词,小管癌比Ⅰ级非特殊型浸润性癌有更好的预后;与小管癌相比,Ⅰ级非特殊型浸润性癌有更少的小管状结构,有更多核的多形性及核分裂。
Javid SH, Smith BL, Mayer E, et al. Tubular carcinoma of the breast: results of a large contemporary series. Am J Surg. 2009;197(5):674‐677.
Leikola J, Heikkilä P, von Smitten K, Leidenius M. The prevalence of axillary lymph-node metastases in patients with pure tubular carcinoma of the breast and sentinel node biopsy. Eur J Surg Oncol. 2006;32(5):488‐491.
Aulmann S, Elsawaf Z, Penzel R, Schirmacher P, Sinn HP. Invasive tubular carcinoma of the breast frequently is clonally related to flat epithelial atypia and low-grade ductal carcinoma in situ. Am J Surg Pathol. 2009;33(11):1646‐1653.
Brandt SM, Young GQ, Hoda SA. The "Rosen Triad": tubular carcinoma, lobular carcinoma in situ, and columnar cell lesions. Adv Anat Pathol. 2008;15(3):140‐146.
Cabral AH, Recine M, Paramo JC, McPhee MM, Poppiti R, Mesko TW. Tubular carcinoma of the breast: an institutional experience and review of the literature. Breast J. 2003;9(4):298‐301.