几乎全部阳性(≥95%的病例阳性):
actin-HHF-35、CD95-fas、EMA、GATA3、IGF-1R、P27、VEGF、Calponin、CK19、CK7、E-cadherin通常阳性(<95%,≥75%的病例阳性):
COX-2、ER、GLUT1、MUC3、NY-BR-1、TIMP-1、TIMP-2、Podoplanin经常阳性(<75%,≥55%的病例阳性):
BCL-2、CA9、CAIX、CD44、P63、PRP、CyclinD1、GCDFP-15有时阳性(<55%,≥35%的病例阳性):
adipophilin、androgen receptor、HER2、P21、p-mTOR、PTEN、TAG72、Clusterin、CD57、NSE少数阳性(<35%,≥15%的病例阳性):
P53、PSMA、VIP、Mammaglobin、Synaptophysin偶尔阳性(<15%,≥5%的病例阳性):
TGF-beta-1、CgA、CK20、CK5/6、S100、SOX10几乎全部阴性(<5%的病例阳性):
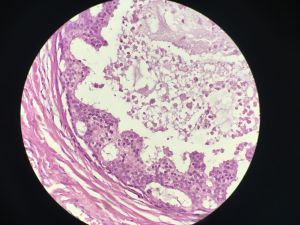
34bE12、FLI-1、PP、Serotonin、CD31、CD56、CK14、NAPSIN-A、PAX8、VILLIN、Calretinin、TTF-11. DCIS主要发生在中老年女性,男性罕见,85%的病例通过乳腺X线筛查发现,典型表现为钙化但无可触及的包块。临床上可触及的乳腺癌中DCIS只占到2-3%,使用X线筛查后DCIS占到乳腺癌的20-30%,主要X线表现是钙化,诊断时的平均年龄50-59岁。
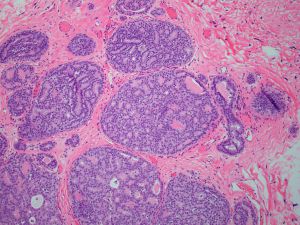
2. DCIS累及的范围:DCIS累及的范围从0.2cm到20cm或乳腺的四个象限,平均累及范围为2-3cm。推荐的最低的诊断低级别DCIS而不是ADH的病变范围标准是>0.2cm或2个完全受累导管,对于高级别DCIS没有病变范围的最低标准。
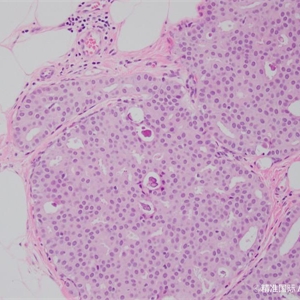
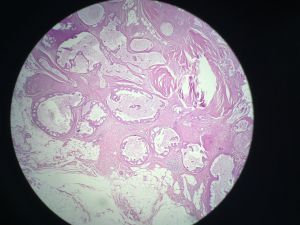
3. 根据细胞及结构的异型性分为低、中、高三个级别核级,低级别及中等级别的DCIS要求符合细胞学标准、结构标准及病变大小标准,高级别DCIS只需要符合细胞学标准。
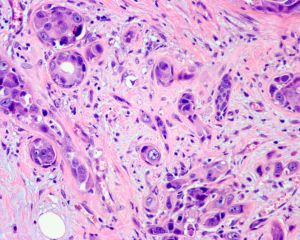
4. 低级别DCIS中的低级别是指圆形、规则或轻度不规则的核,约是红细胞大小的2-3倍,没有粉刺样坏死;中级别DCIS细胞学特征和低级别相同,有粉刺样坏死;高级别的DCIS的细胞核具有多形型特征,是红细胞大小的3倍以上,有粉刺样坏死,但不是必要条件。
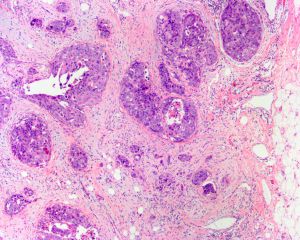
5. DCIS的结构特征:认识不同的结构类型对诊断是有帮助的,分级对预后更有意义,高级别的DCIS可以有任何结构类型,大多数DCIS有一种以上的结构类型。
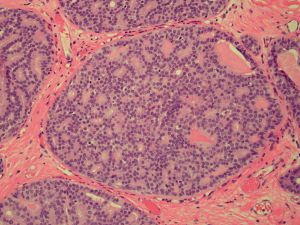
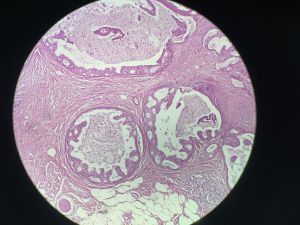
1)筛状型DCIS:筛孔表现为穿凿样或非常圆,在三维结构上是球形的,细胞朝向腔面,受累导管中筛孔分布均匀,而普通型增生的腔隙是蜿蜒曲折的,而且分布在导管周围;筛孔中的分泌物经常钙化,几乎看不到坏死。
2)乳头状型DCIS:分支乳头中央有纤维血管轴心;肌上皮细胞存在于病变周围,但不存在于乳头轴心侧,如果存在于乳头轴心侧则可能说明累及了原有的乳头状瘤;在纤细的血管轴心,血管内皮细胞可以临近肿瘤基地,采用免疫组化使用肌源性标记物很难将肌上皮细胞与血管内皮细胞区别开,P63可以更好的确定乳头状病变肌上皮细胞的消失。
3)微乳头型DCIS:乳头形状是基底纤细,末端膨大呈球形,类似灯泡或鸡腿,由于增生或男性乳腺发育形成的乳头则通常可见增生的背景而且乳头末端呈锥形;乳头没有纤维血管轴心;周围导管通常不增生呈扁平状。
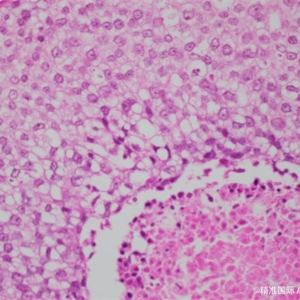
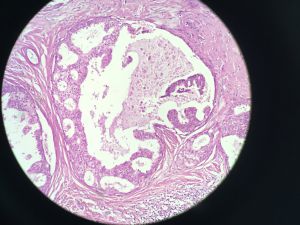
4)粉刺型DCIS:周围是肿瘤细胞围绕,中央坏死,粉刺型DCIS的严格定义要求有中央坏死及高核级别;坏死中几乎总能看到钙化,通常很多,在乳房X线成像中中央坏死轴心可以形成线状或分支状的钙化而显示乳腺导管系统的轮廓,成像显示的病变经常接近实际DCIS的累及范围;存在周围间质纤维化的粉刺型DCIS经常伴有淋巴结浸润,可以形成X线成像中的钙化影;有些病例形成可触及的肿物,由灰白色的纤维化及多灶点状坏死组成。
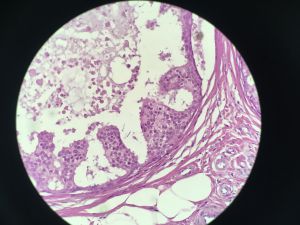
5)实性型DCIS:细胞完全充满导管管腔,具有低级别核的病例可以很难与小叶原位癌鉴别,这时E-cadherin对鉴别诊断会很有帮助。
6)附壁型DCIS:细胞沿管腔排列,不形成任何结构类型,只有在细胞具有高核级别时才可以单独诊断,通常会并存其他更容易诊断的结构类型。
7)派杰样播散:最常见于乳头,类似乳头的派杰氏病;在乳腺导管不常见,因为DCIS是代替正常腔细胞而不是在腔细胞与肌上皮细胞之间浸润。
6. 筛状型、微乳头型、乳头型、附壁型DCIS可以产生粘液,粘液中可以存在钙化,如果导管破裂、粘液外溢,则很难与小灶浸润鉴别,外溢的粘液中不应该有肿瘤细胞。
7. 坏死:DCIS分类系统中有各种坏死类型;粉刺样坏死累及受累导管大部分中央部分,粉刺型DCIS的定义是伴有高核级别的中央坏死的DCIS;局灶坏死仅累及导管小部分;可以看到单个细胞坏死;分泌物碎片和钙化可以类似坏死,真正的坏死有可识别的核碎片。
8. 细胞学特征:DCIS在形态学上表现为单克隆性增生,而普通型增生则是由腔细胞、肌上皮细胞和中间型细胞的混合构成;化生可以使诊断DCIS变得很困难,因为大汗腺化生或透明细胞化生可以使形态学看上去很一致,即使是在良性病变中,所以结构特征、高级别核、坏死或相临的类似表现的浸润性癌的存在对明确诊断DCIS可能是必要的。
9. 核分级对对DCIS的分类是重要的:应用于浸润性癌的三层核分级系统同样适用于DCIS,经常有不同核分级的DCIS混合存在,最高级别的核分级在报告中应当注明。
低级别DCIS诊断要点
A. 病变范围>2mm或累及2个或2个以上完整的导管断面
B. 筛状型的筛孔结构圆而规则
C. 细胞形态一致,界限清楚
D. ER弥漫强阳性,CK5/6常阴性
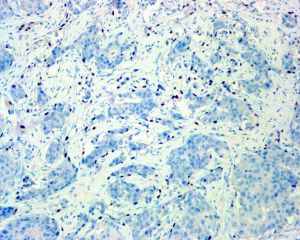
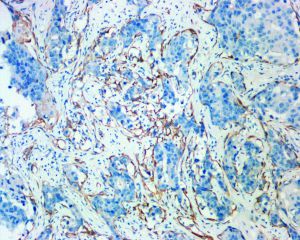
1. 肌上皮标记:对于鉴别DCIS和浸润性癌以及确定微浸润时非常有用,在DCIS时有些肌上皮标记可以表达缺失,其中P63是最不易丢失的肌上皮标记,可以联合使用两种或以上肌上皮标记,胞浆表达的肌上皮标记物比核表达的P63可以检测到更多的肌上皮细胞,肌上皮标志物和细胞角蛋白的双染免疫组化对判断微浸润很有帮助。
2. ER:大约80%的DCIS强表达ER,FEA、ADH及中-低级别的DCIS通常弥漫强阳性表达ER,而UDH经常斑驳地表达ER;ER检测可以帮助做出激素治疗的决定;ER阳性的病理几乎总是PR阳性。
3. E-cadherin:DCIS表达细胞粘附分子E-cadherin,而大多数小叶原位癌(LCIS)则不表达,其对实性的、从HE上无法区分的原位癌的鉴别是有帮助的。
4. HER2:大约30%的DCIS表达HER2,在非常少见的病例DCIS过表达HER2而相关的浸润性癌却不表达,此时如果不将DCIS与浸润性癌区分开,则可能导致基因表达谱、FISH或其他检查结果错误。
5. CK5/6:大多数FEA、ADH和DCIS是阴性的,一些高级别ER阴性的DCIS可以是阳性的;在UDH中CK5/6是斑驳的表达。
1. UDH:由腔细胞与肌上皮细胞混合组成,形成的腔隙不规则而且多位于外周,高分子量细胞角蛋白不均匀分布,中央坏死罕见。
2. 男性乳腺发育样改变:该病变类似男性乳腺发育中乳腺导管增生,一般增生乳头末端逐渐变细,类似蜡烛芯,只有导管增生而没有小叶增生。
3. 乳腺胶原小球病:有增生的腔细胞和肌上皮细胞组成,穿凿样的腔隙类似于筛状型DCIS,肌上皮细胞围绕圆形的充满基底膜样物质的腔隙,这些物质可以表现为胶原样、絮状或粘液样外观,周围经常可以看到深嗜酸性的膜状物,免疫组化可以显示筛孔周围的肌上皮细胞。
4. 放疗引起的不典型改变:放射治疗可以引起正常细胞核增大,放疗反应的细胞常常在正常细胞之间散在,不会形成增生性病变(比如充满管腔、形成乳头或筛状结构),与复发的DCIS有时很难鉴别,在这种情况下不应轻易诊断DCIS。
5. ADH:少量单克隆性增生细胞但是不够诊断DCIS的标准;ADH与低级别的DCIS有类似的分子改变,且二者对高分子量CK都是阴性的;ADH中单克隆形成细胞不能完全充满管腔;如果只有单个导管受累或病变范围<0.2cm,建议诊断ADH,但是如果出现了高级别核则应归为DCIS;如果病变介于ADH与DCIS之间,建议诊断ADH。
6. LCIS:细胞形态单一,缺乏粘附性;大部分不表达E-cadherin,非常少见的情况可以表达E-cadherin,但是其他的细胞粘附分子是无功能的;LCIS不会形成乳头、微乳头或筛状结构,LCIS累及ADH可以类似DCIS;中-低级别的实性DCIS很难和LCIS鉴别,这种情况做免疫组化E-cadherin通常是有帮助的;很少的LCIS(变异型LCIS)可以有高级别核或中央坏死,在过去这种病变可能被分类为DCIS,但是E-cadherin失表达使人们认为其更可能是一种小叶肿瘤;未经处理的变异型LCIS的临床预后不明,因为其大多数是按照DCIS进行处理;这种病变的命名包括多形型LCIS、具有导管和小叶特征的原位癌以及变异型LCIS。
7. 原位实性乳头状癌:围绕纤维脉管轴心生长的癌细胞,形成境界清楚的细胞巢,可以是单个或多个细胞巢,有些是梭形细胞排列模式很难与普通型增生鉴别,通常表达CgA和Syn,周围可以有或没有肌上皮细胞,如果存在肌上皮细胞则病变归类为DCIS,如果没有肌上皮细胞且周围没有明确的间质浸润,WHO推荐归类为DCIS,因为这种病例罕见存在淋巴结转移。
8. 包裹型乳头状癌:癌组织充满界限清楚的空间,通常位于乳头深部,可以有乳头溢液,在纤维脉管芯及癌组织周围没有肌上皮细胞,预后良好,几乎没有淋巴结转移,WHO推荐归类为DCIS,如果存在明确的浸润区域,则浸润区域不应该包括包裹型乳头状癌区域。
9. DCIS伴有微浸润:常常发生在高级别且病变广泛的DCIS,间质纤维化和淋巴细胞浸润可以造成诊断困难,微浸润的定义是浸润间质的癌细胞< 0.1 cm,如果只有1-3个灶的微浸润,临床预后一般类似于DCIS,罕见的有多灶微浸润的病例可以与淋巴转移和远处转移有关。CK与肌上皮标记物的免疫组化双染对判断微浸润有帮助。
10. 浸润性癌:有些浸润性癌呈界限清楚的癌巢,浸润的筛状结构可以类似DCIS。癌组织在间质中通常是杂乱排列,失去正常导管和小叶的排列模式,促结缔组织反应一般在癌细胞之间而不是像DCIS那样在外周,在困难病例,肌上皮细胞的免疫组化染色是有帮助的。