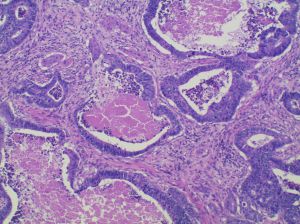
1. 多数为中年人及老年人,男性发病多于女性,常见症状包括排便习惯持续改变、贫血、便血和腹痛,早期可能没有临床症状。
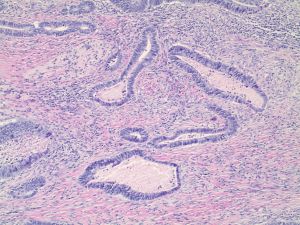
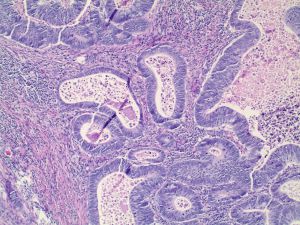
2. 外观变化多样,有内生型和外生型,伴不同程度纤维化,常表现为边缘微隆起的溃疡。
3. 组织学变化多样,2019年WHO将结肠癌分为以下组织学亚型:
3.1 腺癌非特指型 (adenocarcinoma NOS):肿瘤呈不同程度的腺管分化,可伴有少量(<50%)粘液癌、印戒细胞癌等
3.2 黏液癌 (mucinous carcinoma):>50%的区域由细胞外黏液池构成
3.3 印戒细胞癌(Signet-ring cell carcinoma):50%以上的区域由印戒细胞构成。
3.4 髓样癌(Medullary carcinoma)由合体细胞样细胞够承德实性细胞巢构成,伴淋巴细胞和中性粒细胞浸润。
3.5 锯齿状腺癌(serrated adenocarcinoma):形态与锯齿状腺瘤相似,细胞异型不明显,但穿透黏膜基层侵及黏膜下层
3.6 微乳头状腺癌 (micropapillary adenocarcinoma):50%以上的区域表现为在类似于血管腔的空隙内分布实性簇状细胞巢,中央缺乏纤维血管轴心。
3.7 腺瘤样腺癌(Adenoma-like adenocarcinoma):50%以上区域呈低级别绒毛状腺瘤形态,呈推进性生长方式
3.8 腺鳞癌(Adenosquamous carcinoma):具有腺癌与鳞状细胞癌两种成分,2中成分间有明显的界限。
3.9 癌伴肉瘤样成分(Carcinomas with sarcomatoid components):肿瘤部分区域呈肉瘤样形态,具代表性ing的形态为横纹肌样细胞。
3.10 未分化癌(Undifferentiated carcinoma):上皮源性恶性肿瘤,形态学及免疫表型不能明确其分化方向。
4. 结直肠腺癌的分级:腺癌分级缺乏统一的标准,病理医生间重复性差。2019年WHO消化系统肿瘤分类将结肠癌分为两级,评级基于分化最差区域,但侵袭性前沿肿瘤出芽的地方是上皮-间质转化的标志,在肿瘤分级时不应考虑,而应单独报告。
4.1 低级别(包括以前的高分化及中分化两个级别):不同分化程度的腺管或筛状结构
4.2 高级别(以前的低分化腺癌)肿瘤:由实性巢状、片状、条索状结构构成,无明确的腺管分化。
5. 与预后相关的形态学
5.1 肿瘤出芽(tumor budding):HE切片中肿瘤浸润前缘出现单个细胞或4个以下(含)细胞构成的细胞族称为肿瘤出芽;肿瘤出芽分为三级。在20倍目镜(0.785mm2 )下选定一个热点区域进行瘤芽计数, 0-4个为低级别, 5-9个为中级别, 10个以上为高级别。
5.2 低分化细胞族(poorly differentiated clusters):在肿瘤浸润前缘出现5个或5个细胞组成的实性细胞族称为低分化细胞簇;
5.3 生长方式
5.3.1 浸润性生长(infiltrative growth):与预后不良相关
5.3.2 推进性边缘(pushing borders):与预后良好相关
5.4 淋巴浸润:淋巴管内(被覆内皮的脉管,腔内无红细胞)单个或成群的肿瘤细胞,是淋巴结转移的危险因素;
5.5 血管侵犯(vascular invasion)
5.5.1 肠壁血管侵犯(IMVI):报告发生频率4-40%不等,平均12.5%,与预后不良相关
5.5.2 肠壁外血管侵犯(EMVI):发病率较IMVI更高,预后风险也更高,但通常被忽视。帮助判定EMVI的形态学特征有孤动脉征(orphan artary sign)和舌突征(protruding tongue sign)。前者在邻近动脉区域见可疑静脉内肿瘤结节(正常情况下动静脉伴行,当发现动脉旁没有明确的伴行静脉,但有肿瘤结节,该结节在可疑静脉腔内)。后者肿瘤呈舌状突出肿瘤边界进入周围脂肪的静脉。
5.6 神经周围侵犯(perineural invasion):肿瘤细胞围绕神经至少1/3圈,侵犯神经外膜、神经束膜和神经内膜均可认定为神经周围侵犯,发生率20%左右。与局部复发、远处复发和生存率低相关。
5.7 免疫反应(immune response)肿瘤内淋巴细胞和克罗恩样反应(浸润性大肠癌的固有肌层或周围纤维脂肪组织内存在淋巴细胞聚集灶,有些可以有生发中心,此前没有克罗恩病的症状及病理学证据)与较好的预后相关。这两个特征都与MSI有关。
5.8 切缘(resection margins):
5.8.1 近端和远端是最容易区分,当肿瘤位于这些纵向边缘附近时,局部复发的风险会增加,尤其是在直肠癌术前未进行放射治疗的情况下;
5.8.2 环周切缘更重要,如果肿瘤和切缘之间的距离≤1 mm,则认为是阳性,阳性切缘对局部复发和总生存率有很强的影响;
5.8.3 与预后最密切相关的是原发灶累及边缘。由淋巴结阳性、肿瘤沉积、血管侵犯和神经周围生长而引起的切缘受累较少,似乎对预后影响较小;
5.8.4 对于局部切除标本,最重要的边缘是基底边缘,侧切缘阳性并不影响局部复发率;
5.8.5 根治标本的完整性和所达到的切除平面是重要的预后因素和质量指标。直肠和结肠肿瘤的最佳手术平面分别是直肠系膜筋膜和结肠系膜平面,切除平面不达标与预后差有关。
5.9 治疗反应(therapy response)新辅助治疗的应用,即直肠癌的放疗或放疗联合化疗或系统性治疗均引起相应的组织病理学反应,该反应的谱系从完全性病理反应到没有可检测到的改变均可见到。关于治疗反应有很多的分类系统,但重复性均不理想。
警示:
肠镜活检小标本的诊断往往具有挑战性,实际工作中常见以下几种风险,科室讨论或专科病理医生会诊可减少这些风险的发生率:
1) 过诊断:将假浸润误认为是真浸润,把良性病变、反应性病变或癌前病变误诊为浸润性癌,造成临床过度治疗;
2) 低诊断或漏诊:将分化好的浸润性癌误诊为良性,造成患者失去手术切除的机会;
3) 肿瘤分类错误:如将高分化神经内分泌瘤误诊为浸润性腺癌,同样会造成临床治疗失当;
4) 不明确的诊断:由于取材的限制及病理医生受训、工作经验限制,病理医生在发报告的时候倾向于保守,常用倾向、可能、不排除等术语,导致临床医生不能确定治疗方案,这些病例经经验丰富的专家或专科病理医生会诊,部分病例是可以明确诊断的。
目前结直肠癌分子分型有两种方法,一种是是由癌症基因组图谱(TCGA)工作网络基于DNA的分类,另一种是利用RNA测序或基于阵列技术的转录组分析方法。
基因组分型方法:根据突变率将结直肠癌分为高突变组和非高突变组。
高突变组:15%的结直肠癌具有高突变率,该组病例大部分(~13%)显示微卫星不稳定(MSI),这包括散发性MLH1启动子高甲基化导致MLH1表达缺失的MSI高突变和DNA错配修复失活两种情况。另外2-3%为超突变型,其突变频率非常高,原因是突变造成 DNA复制酶POLE(偶尔是POLD1)外切酶区域的校对功能失活,从而导致特征性的由碱基C变为A的突变增加。超突变组和高突变组同合并为一组,统称为高突变组,比非高突变组具有显著增多的突变。
低突变组:约占85%,具有低频突变,且微卫星稳定(MSS)。
转录组分析法:该方法将结直肠癌分为4个主要共识分子亚型(consensus molecular subtype CMS)
CMS1 :MSI-immunel,占14%,几乎所有MSI高突变肿瘤都落在该组;
CMS2:canonical,37%,
CMS3:metabolic. 13%
CMS4:mesenchymal, 23%
其它:未分类组,mixed features, 13%
1. 腺瘤伴假浸润:以下特点提示假浸润:息肉茎部异型增生的腺体周围可见固有层样炎症,吞噬含铁血黄素的巨噬细胞,腺体下延改变伴平滑肌分化而不是真正的粗纤维间质反应,息肉的异型程度与茎部的异型程度一致。注意的是右半结肠息肉的假浸润诊断需要小心,有可能为真的浸润。
2. 转移性腺癌:肿瘤边缘缺乏腺瘤的区域,CK7、CK20及CDX-2可能对诊断有帮助。
预后生物学指标:
1. RAS基因:有3个RAS基因,其中2个(KRAS、NRAS)具有治疗意义。几乎50%的结直肠癌患者有RAS突变,突变病例对抗EGFR抗体治疗抵抗,而40-60%RAS野生型病例对抗EGFR抗体治疗反应。
2. BRAF基因:BRAFp. V600E突变为结直肠癌预后不良因素,BRAF突变可以排除Lynch综合征。同时RAS与BRAF突变相互排斥。有些研究表明BRAF p. V600E突变结直肠癌患者不能从抗EGFR抗体治疗中获益。
3. 微卫星不稳定(MSI):在BRAF野生型病例中,MSI为预后良好因素。无论BRAF状态如何,MSI降低了基于氟尿嘧啶化疗的获益度。在BRAF突变的情况下MSS提示预后较差。其次,MSI的存在对癌症免疫治疗有重要作用。最近,研究报告了在常规治疗失败的患者中MSI癌症(CRCs和其他)对PDL1抑制剂有显著反应。在结直肠癌中,该检测可作为肿瘤突变负荷检测的替代品。
4. PIK3CA:10-20%的结直肠癌存在PIK3CA突变,该突变与预后不良有关,并提示对抗EGFR单抗治疗不敏感
5. c-Met:MET拷贝数增加或MET外显子14跳跃性突变( exon 14 skipping mutations)可能代表对c-Met抑制剂治疗敏感的潜在预测标志物。
6. 液体活检:所有可能在血液中进行的检测(检测循环肿瘤细胞、外泌体或游离DNA)样本中检测(K)RAS和BRAF突变等生物标志物可能在不久的将来得到广泛接受。