1. 最常见的胶质瘤,占颅内肿瘤的15%,颅内恶性肿瘤的45-50%,年发病率3-6/100000(欧美)。各年龄组均可发病,发病高峰为55-85岁。
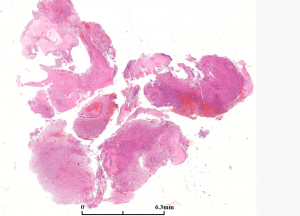
2. 大体:多数呈广泛浸润脑组织,可见坏死。
3. 病变界限不清,浸润性生长伴继发性改变(神经周围卫星现象、血管周围及软膜下聚集),偶见界限清楚(至少部分,尤其是巨细胞亚型、上皮样、横纹肌样及脑膜受累的任何类型)。
4. 扩散的方式:可见直接局灶受累、室管膜下、脊椎内软脑膜及系统性受累(骨髓、肝脏及淋巴结)。
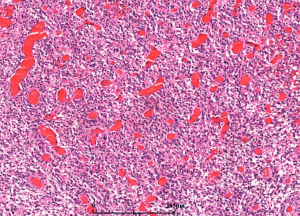
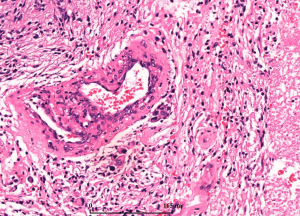
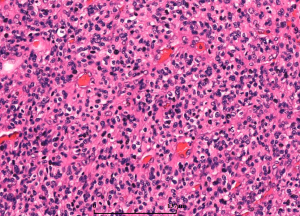
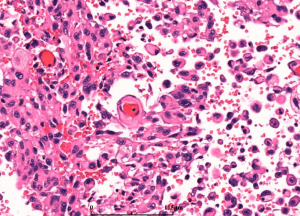
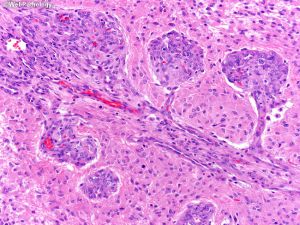
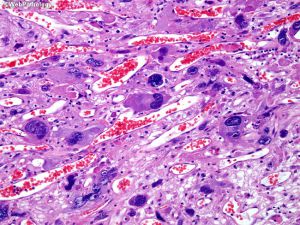
5. 镜下:可见凝固性坏死伴或无假栅栏状,肾小球样血管增生,多层、腔内内皮细胞增生,小血管血栓形成。
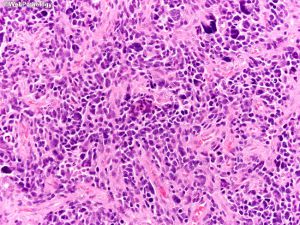
6. 多数小细胞亚型可见核分裂,少数位于治疗后“静止”期的肿瘤。可见凋亡,尤其位于假栅栏状区域。
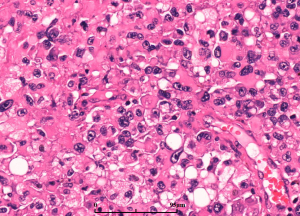
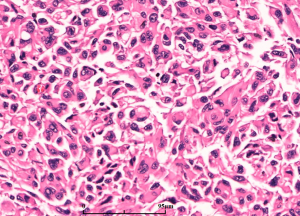
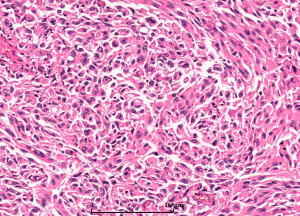
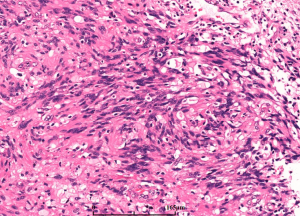
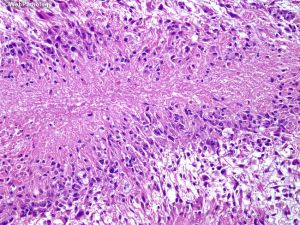
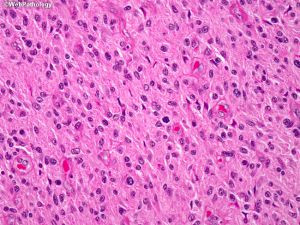
7. 细胞异质性和模式(pattern): 胶质母细胞瘤具有丰富的细胞异质性,细胞形态包括:小细胞、未分化细胞、胖细胞、梭形细胞、脂肪化、颗粒状、上皮样、巨细胞等,上述细胞有时成为主要成分,并形成多种特征的形态学模式
7.1 胖细胞:胶质母细胞瘤中可出现多少不等的胖细胞,当胖细胞>20%时可诊断胖细胞为主型(major tissue pattern)
7.2 巨细胞与巨细胞胶质母细胞瘤:当肿瘤中以奇异或多核巨细胞为主时,可称为巨细胞胶质母细胞瘤(少见,<1%)。
- 年轻患者大量多核巨细胞与POLE或DNA错配修复基因突变有关,免疫组化可表现为错配修复蛋白丢失。
- 该形态胶质母细胞瘤预后较普通胶质母细胞瘤稍好(平均生存期11VS13.5个月)
7.4 胶质肉瘤:可用于伴显著间叶分化的病例,其特征是具有胶质和肉瘤成分(GFAP、OLIGO2阴性)双向分化
7.5 上皮化生:少见,包括腺样或鳞状化生化生,甚至可见角化珠
7.6 上皮样胶质母细胞瘤:粘附性差的大的胞质丰富、泡状核,核仁突出的上皮样-横纹肌样细胞聚集成界限清楚的细胞巢,有时似转移癌或恶性黑色素瘤。有些病例可见巨细胞、脂化细胞、促结缔组织增生、胞质空泡等,有时可表现为多形性黄色瘤性星形细胞瘤样结构。
7.7 少突细胞样细胞:有些病例可伴有少突胶质细胞样区域,细胞核圆形,胞质透亮,细胞膜清晰,有时可见鸡爪样血管及微钙化
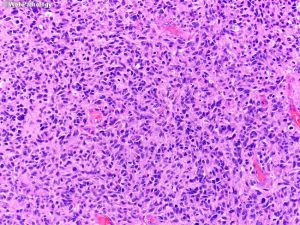
7.8 小细胞和小细胞胶质母细胞瘤:细胞形态一致,体积小,圆或短长形,核深染,核分裂活跃,胞质少,小细胞成分可多可少。当以小细胞为主时可称为小细胞胶质母细胞瘤。
7.9 原始神经元细胞和胶质母细胞瘤伴原始神经元成分:少数病例可显示伴神经分化的不成熟实性结节,结节与周围分解清楚,表现为细胞密度显著增高、核质比例高,核分裂和核固缩易见。其它形态包括Homer-wright菊型团、cell wrapping、髓母细胞样间变细胞、其它中枢神经胚胎性肿瘤
7.10 颗粒细胞和颗粒细胞胶质母细胞瘤:有些病例可见散在大细胞,胞质颗粒状,PAS阳性。罕见病例以颗粒细胞为主,似其他部位的颗粒细胞瘤,有些病例可见颗粒细胞样成分与星形细胞成分过渡,有些病例很难确定普通的星形细胞成分。当颗粒细胞成分为主时可称为颗粒细胞胶质母细胞瘤。
7.11 脂化细胞和重度脂化胶质母细胞瘤:胶质母细胞瘤可偶尔出现泡沫状胞质细胞,当脂化细胞为主时可称为恶性胶质瘤伴重度脂化。
- 微血管增生(小血管内皮细胞呈多层)
- 坏死
- TERT启动子突变
- EGFR基因扩增
- 拷贝数改变:+7和-10(+7和-10 可单独发生,但不是诊断胶质母细胞瘤的条件)
- 巨细胞胶质母细胞瘤
- 胶质肉瘤
- 上皮样胶质母细胞瘤
IDH野生型胶质母细胞瘤IDH1 p.R132H的免疫组化染色阴性,并且对H3 p.K28M (K27M), H3.3 p.G35R (G34R)或H3.3 p.G35V (G34V)的突变特异性抗体呈阴性反应。
ATRX的核免疫染色在绝大多数肿瘤中保留,p53的核阳性在大约25-30%的肿瘤中广泛阳性。细胞核p53阳性在巨细胞胶质母细胞瘤亚型中尤为常见。
胶质母细胞瘤常表达GFAP,但不同病例间的反应程度有显著差异;例如,胖细胞区通常呈强烈阳性,而原始细胞成分通常呈阴性。
S100表达也很常见。
OLIG2是一种高度特异性的胶质瘤标志物,可能具有诊断用途,在星形细胞瘤和少突胶质细胞瘤中比在室管膜瘤和非胶质肿瘤中更常见,低核表达OLIG2 (<30%)辅助治疗后复发时间更短,生存期更短{31568682}。
细胞角蛋白阳性可能主要表明与GFAP具有交叉反应性;AE1/AE3免疫染色最常呈阳性,而大多数其他角蛋白均未检测到阳性。
胶质肉瘤中的肉瘤成分通常缺乏胶质标记物的表达,但对波形蛋白反应阳性。少数病例可能表现出沿肌源性或其他间充质谱系分化的标记物的表达。
肿瘤干细胞生物标志物如CD133、CD44、SOX2、OCT4和nestin可能在胶质母细胞瘤中表达;但在诊断工作中意义有限
EGFR常阳性,在EGFR扩增的肿瘤中表达尤其强烈,其中约一半的肿瘤另外显示EGFRvIII免疫阳性。
- 测序,非突变;
- 免疫组化,IDH1 p.R132H阴性
H3.3 p.G35R(G34R)、H3.3 p.G35V(G34V)突变免疫组化检测或H3-3A(H3F3A)测序以排除H3 G34突变弥漫半球胶质瘤
TERT启动子突变:与更高的侵袭性相关
EGFR基因扩增或过表达:与预后差相关,EGFR(7p11.2)扩增诊断敏感性和特异性分别为36%和100%
+7/-10拷贝数改变:诊断敏感性和特异性分别为59%和98%
甲基化普检测:显示胶质母细胞瘤甲基化普可以确诊
BRAFp.V600E:测序,少见突变,但可见于50%的上皮样、79%的多形性黄色星形细胞瘤样、35%成人型病例
TP53:测序,突变见于1/4的病例,>80%巨细胞胶质母细胞瘤
MYC或MYCN:见于原始神经元成分(primitive neuronal component)
MGMT启动子甲基化状态:生存期长独立影响因素,烷化剂治疗、甲基化化疗(methylating chemotherapy)敏感强标志物
分子靶标治疗:肿瘤突变负荷、BRAFp.V600E、NTRK或FGFR基因家族融合、MET扩增或融合
1. 间变型少突胶质细胞瘤:细胞形态单一,核呈圆形,常与II级少突胶质细胞瘤相关,1p/19q共同缺失。
2. 间变型室管膜细胞瘤:局灶可见浸润,形态单一,血管周围假菊形团,真正菊形团不常见,微管点状EMA阳性,菊形团表面EMA阳性。
3. 转移性肿瘤:边界尚清,可见上皮或黑色素特征,无血管增生的特点(肾脏除外),上皮或黑色素标记阳性,邻近脑组织的外周血管、淋巴管浸润。
4. 原发性CNS淋巴瘤:血管中心性,导致淋巴瘤细胞片状分布,细胞胞核圆形或不规则,核仁显著及胞浆稀少,可见大量凋亡,无血管增生。
5. 髓母细胞瘤(小脑):结节-促结缔组织增生可见结节及网状蛋白,少许或无胶质分化,Synaptophysin阳性,坏死不常见,常无假栅栏状,微血管增生罕见。
6. 原始神经外胚叶肿瘤(幕上):Synaptophysin阳性,部分病例可见结节状结构。
7. 急性/亚急性梗死:血管细胞肥厚(最低限度的增生),亚急性及慢性阶段可见巨噬细胞。
8. 脓肿:无恶性细胞,呈急性炎症,显著的淋巴浆细胞浸润,机化组织中纤维母细胞增生或囊性改变。