1. 大多数发生于20-40岁,中位年龄38岁,儿童少见。可位于中枢神经系统的任何区域,包括脑干和脊髓,但它们最常发生在幕上,通常集中在额叶内或附近区域。
2. 临床表现:大脑半球病变可引起癫痫;根据肿瘤部位不同而产生相应的神经功能缺陷;因脑室阻塞导致的颅内压增高的症状及体征;
3. 大体:肿瘤界限不清;可伴有大小不等的囊腔,偶尔呈广泛的微囊状,或单个充满透明液体的大囊。高级别者可见出血坏死
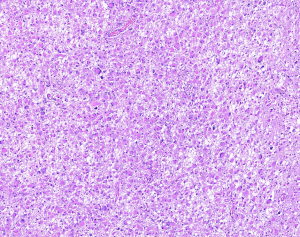
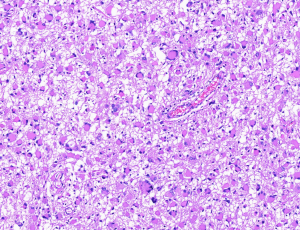
4. 组织学:从分化良好、低细胞密度和生长缓慢的肿瘤(CNS WHO分级2级)到高度异型性、细胞密度显著增高、核分裂活跃、微血管增生及坏死等(CNS WHO分级4级)。
4.1 WHO 2级
4.1.1由分化良好的原纤维胶质细胞组成,这些细胞弥漫性地浸润脑实质,通常缺乏细胞建黏附性,结构松散,常伴微囊性结构。
4.1.2 与正常脑相比,细胞密度轻度至中度增加,并伴有轻度核异型性。细胞大小、细胞质丰富程度和细胞突起多少不等。细胞核增大,细胞核轮廓不规则,染色质分布不均匀,核仁通常不明显,大多数情况下不可见。
4.1.3 偶尔形态与少突胶质细胞瘤重叠;
4.1.4 与反应性星形细胞增生的细胞不同,IDH突变型星形细胞瘤肿瘤细胞之间细胞突起多少不等。
4.1.5 在CNS WHO 2级肿瘤中有丝分裂活动不存在或不常见。
4.2 CNS WHO 3级:
4.2.1 区分CNS WHO 3级星形细胞瘤和CNS WHO 2级星形细胞瘤的主要特征是有丝分裂活性增加和组织学上的间变性。然而,在IDH突变星形细胞瘤队列中,CNS WHO分级3级的阈值尚未确定。一般来说穿刺活检标本中见1个核分裂像就应分为3级,切除标本中2个有丝分裂符合CNS WHO3级。
4.2.2 WHO CNS 3级肿瘤也经常表现为细胞密度增加和核非典型性增加,包括核大小和形状的变化,染色质粗糙和分散。
4.2.3 没有微血管增生(血管内的多层内皮)和坏死。
4.3 CNS WHO 4级:在3级形态学基础上出现微血管增生和/或坏死。
5. 在所有级别的IDH突变型星形细胞瘤中,可以观察到局部、区域或几乎一致的胖细胞分化。
5.1 胖细胞的特征是胞质丰富、磨玻璃状、嗜酸性伴粗壮的、杂乱的突起,形成粗纤维网络。细胞核常偏心,核仁小而明显,染色质密集团块状;
5.2 当胖细胞占所有肿瘤细胞的20%以上(>20%)时可诊断为胖细胞为主模式;
5.3 这种胖细胞组织模式并不是IDH突变型星形细胞瘤所特有的,也可以在IDH野生型胶质瘤中发现。
6. 血管周围袖套状淋巴细胞浸润与包含CCND2的12p染色体的局灶性增益有关,与临床行为没有明确的联系。
诊断标准:
必要条件
弥漫浸润胶质细胞肿瘤
IDH1 132 外显子或IDH2 172 外显子错义突变
ATRX表达缺失或ATRX突变或者排除1p/19q全臂缺失
支持条件:
TP53突变或10%的肿瘤细胞p53强核表达
星形细胞的形态分化
WHO CNS分级标准:
WHO 2级:
- 弥漫浸润性生长
- 细胞密度增加,轻度异型
- 核形不规则、染色质不均匀、染色质增加,核仁不明显或无核仁,偶尔可呈少突胶质细胞形态
- 无或所有切片合计核分裂像<2个
- Ki-67指数通常<4%
- 缺乏CDNK2A/B 纯合缺失
WHO 3 级
- 细胞明显异型
- 核大小、形态不一,可见多核瘤巨细胞,染色质粗,分散
- 可见核分裂像(所有切片合计核分裂像≥2个,活检小标本1个核分裂即可诊断3级)
- Ki-67指数通常4~10%
- 缺乏肿瘤性坏死及微血管增生
- 缺乏CDNK2A/B 纯合缺失
WHO 4 级(满足下列条件中的一种即可诊断)
- 3级形态基础上的微血管增生
- 3级形态基础上的肿瘤坏死
- CDNK2A/B 纯合缺失
- Ki-67指数变化不一(不作为诊断的必要条件)
额外基因突变可导致肿瘤分级增高
大约90%病例伴有TP53 和 ATRX 突变(常共突变),ATRX 突变和 1p/19q 共缺失相互排斥
55岁以上CNS WHO 4级胶质瘤IDH1/2突变率很低,可免除测序检测
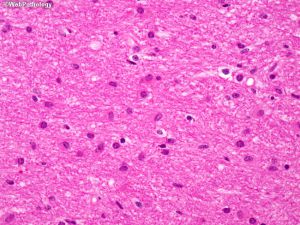
1. 正常脑组织:细胞量较少及分布均匀,无微囊形成,细胞无不典型性,Ki67极低至零,IDH-1(-)及p53(-)。
2. 非特异性胶质细胞增生:均匀分布的肥厚的纤维性或肥胖性星形细胞,部分未治疗的星形细胞瘤病例可见含铁血黄素,Ki67标记指数较低,IDH-1(-),P53阴性或弱阳性,7号染色体完整。
3. 脱髓鞘病:边界清楚,大量巨噬细胞和反应性星形细胞,血管周围淋巴细胞浸润,髓磷脂缺失及轴突正常,IDH-1阴性,散在细胞P53弱至中度阳性,7号染色体完整。
4. 少突胶质细胞瘤:细胞分布均匀一致,细胞形态较单一,圆形核伴染色质分散及显著的核仁,神经元周围常见卫星现象及软脑膜下聚集,核周可见空晕(“煎蛋”样),纤维性背景较少,可见皮质内钙化,1p/19q共同缺失,无P53突变,但可见P53免疫标记阳性。
5. 毛细胞性星形细胞瘤:通常边界清楚,结构紧凑,但有时周边可见浸润,尤其位于小脑及视神经的肿瘤,具有双相排列(海绵状微囊性组织伴嗜酸性颗粒小体及致密的Rosenthal纤维),部分可见肾小球样血管结构,出现MAPK通路激活,IDH-1(-)。
星形细胞瘤,IDH突变型,3级 OS 5-10年
星形细胞瘤,IDH突变型,4级 OS 3 年