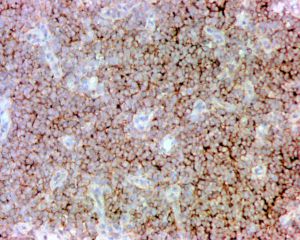
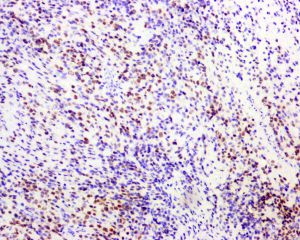
几乎全部阳性(≥95%的病例阳性):
Vimentin通常阳性(<95%,≥75%的病例阳性):
S100几乎全部阴性(<5%的病例阳性):
actin-HHF-35、CEA-M、CK-PAN、CD34、Desmin1. 罕见,多发于10-30岁。临床表现为肢端痛性或无痛性肿块。
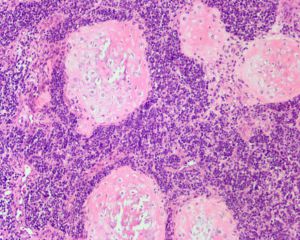
2. 大体上呈边界清楚,分叶状,大小2-37cm,中央常伴颗粒状组织或软骨灶,周围较软呈鱼肉样,部分可见坏死及出血。
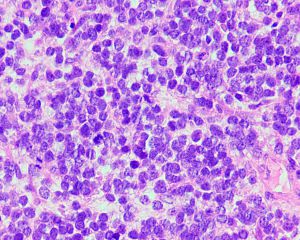
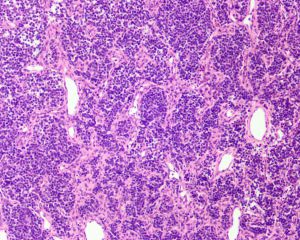
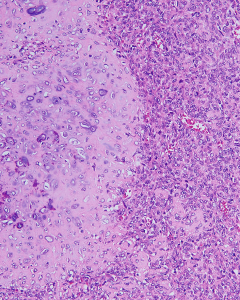
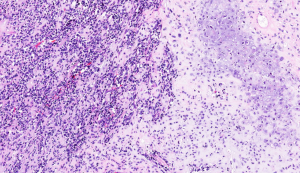
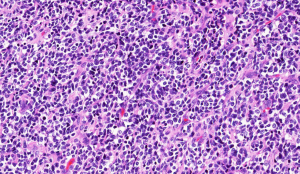
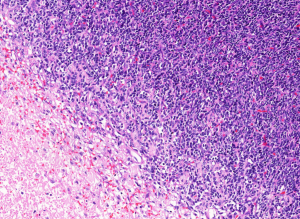
3. 组织学上可见小圆形或梭形细胞及透明软骨两种形态。
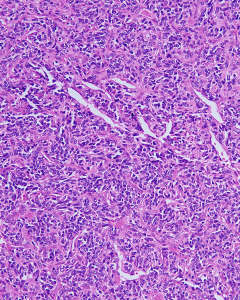
4. 小圆形或梭形细胞呈簇状或束状排列,呈均一圆形、卵圆形或梭形胞核,染色质深染及粗颗粒状,胞浆稀疏,核分裂像多少不一。
5. 透明软骨显示大小岛状不等分布,部分呈片状;陷窝内可见小的胞核深染的细胞,细胞形态温和或轻度异型。
6. 富于细胞区域与软骨之间逐渐过渡或界限分明。
7. 常见钙化及软骨内骨化,可见分支状薄壁血管,部分可见坏死或出血
1. 尤文肉瘤:均匀一致小圆形细胞,染色质粗糙程度不如EMC,缺乏软骨成分,缺乏分支状血管,多数胞浆内富于糖原,CD99、FLI-1及ERG阳性,SOX9(+/-),RT-PCR显示EWS-FLI1或EWS-ERG重排。
2. 滑膜肉瘤:梭形或小圆形细胞,可见外皮细胞瘤样血管结构,部分可见化生性骨化,缺乏透明软骨,Keratin、EMA、CD99、TLE1及SOX9阳性, SSX-SYT重排阳性。
3. 孤立性纤维性肿瘤:梭形细胞杂乱无章或席纹状,丝状胶原束,外皮细胞瘤样血管结构,可发生在脑膜。缺乏透明软骨,CD99、CD34及STAT6阳性。
4. 骨肉瘤:可见小细胞或软骨母细胞特征,Osteocalcin阳性,而SOX9阴性。
5. 恶性神经鞘膜瘤(MPNST):少数可见异源性软骨成分,常见束状梭形细胞,可见小圆形细胞,亦可见血管外皮细胞瘤样血管,约50%显示局灶S100阳性。
6. 不典型畸胎样横纹肌样瘤(Atypical Teratoid Rhabdoid Tumor):病变位于颅内,显示小圆形细胞,大量嗜酸性胞浆,缺乏软骨成分,Keratin阳性,而SNF5 (INI1)胞核阴性。
7. 硬化性横纹肌肉瘤:显示小圆形或梭形细胞,类似软骨的透明样基质,软骨成分缺如,横纹肌母细胞常稀疏,Desmin阴性,MYOD1阳性,myogenin(+/-)。而EMC约50%显示desmin阳性,极少数显示MYOD1或myogenin局灶阳性。
8. 骨外黏液样软骨肉瘤:丰富黏液样基质,上皮样或梭形细胞索状排列,很少出现形成良好的软骨,SOX9阴性。
Shakked RJ, Geller DS, Gorlick R, Dorfman HD. Mesenchymal chondrosarcoma: clinicopathologic study of 20 cases. Arch Pathol Lab Med. 2012;136(1):61–75.
Fanburg-Smith JC, Auerbach A, Marwaha JS, Wang Z, Rushing EJ. Reappraisal of mesenchymal chondrosarcoma: novel morphologic observations of the hyaline cartilage and endochondral ossification and beta-catenin, Sox9, and osteocalcin immunostaining of 22 cases. Hum Pathol. 2010;41(5):653–662.
Wang L, Motoi T, Khanin R, et al. Identification of a novel, recurrent HEY1-NCOA2 fusion in mesenchymal chondrosarcoma based on a genome-wide screen of exon-level expression data. Genes Chromosomes Cancer. 2012;51(2):127–139.
Folpe AL, Graham RP, Martinez A, Schembri-Wismayer D, Boland J, Fritchie KJ.
Hum Pathol. 2018 Jul;77:28-34. doi: 10.1016/j.humpath.2018.03.012. Epub 2018 Mar 17.