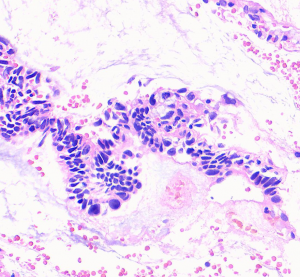
1. 平均发病年龄31-40岁,多发于宫颈移行区,少数可发生于宫颈管近端,常与宫颈高级别鳞状上皮内瘤变相伴出现;90%以上的病例HPV16和/或HPV18阳性;
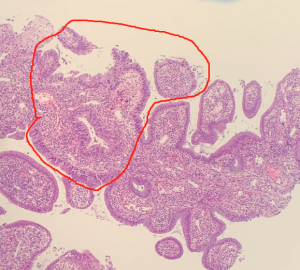
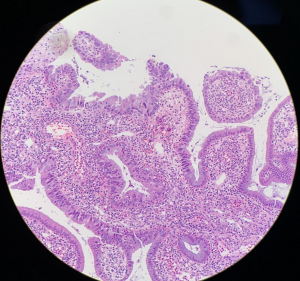
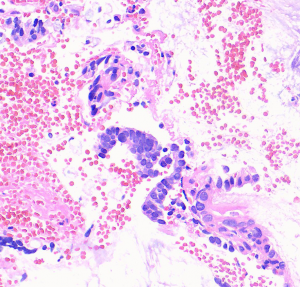
2. 镜下宫颈腺体原有结构保存,被覆上皮多为假复层柱状细胞,通常缺乏黏液,细胞核假复层,染色深,有丝分裂象位于细胞顶端,核破裂位于细胞基底部;
3. 除上述细胞形态外,还可见多种形态的细胞:胞浆内可见明显黏液的细胞; 具粉红色顶端胞浆的细胞; 纤毛细胞; 核不同程度增大、深染,长形或圆形,有时核轮廓不规则,染色质粗糙: 多核细胞;
4. 可见所谓的早期或浅表原位癌,病变局限且位于宫颈管腔表面的单层细胞,细胞核大小均匀,有丝分裂或凋亡小体少见。核仁很少出现。
4. 部分病例可以显示腺内筛状和乳头状结构,这时应于非破坏性浸润的腺癌浸润,筛状或乳头状结构达多大范围可诊断浸润性腺癌还存在争议,一般认为当这些病变仅局部出现,且样本可完整显示病变区域时应诊断原位腺癌;如病变广泛则应诊断浸润性腺癌,包括绒毛状管状腺癌。
5. 复层产粘液上皮内瘤变为原位腺癌的一个亚型:
5.1 低倍镜下该病变类似宫颈高级别鳞状上皮内病变累及宫颈腺体
5.2 高倍镜下可见明显的胞质内黏液,细胞核具非典型性,染色深,通常可见有丝分裂和凋亡小体;
5.3 上皮巣周围可见袖套样的基底细胞和储备细胞;
5.4 该亚型可能与HSIL、经典AIS或浸润性癌同时存在。
特征性形态学结构:假复层细胞核,核染色深,细胞顶端核分裂像,位于细胞基底的核碎
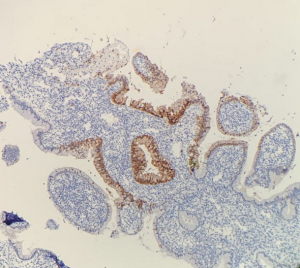
子宫内膜样腺癌:AIS缺乏粘液时应与子宫内膜样腺癌鉴别,p16弥漫强阳性支持原位腺癌,具子宫内膜非典型增生形态,鳞状化生,细胞呈柱状、卵圆形核,缺乏明显的有丝分裂活动等支持子宫内膜样腺癌。当存在杯状细胞时,应怀疑是AlS,但无论HPV状态如何,杯状细胞本身并不能诊断AlS。
宫颈输卵管内膜样化生/反应性增生:纤毛细胞型原位腺癌缺乏明显核异型时应和宫颈输卵管内膜样化生鉴别,前者常具有明显的核分裂像,而后者几乎无核分裂像;p16弥漫阳性(可能随着肠化而降低表达),Ki-67增殖指数增加等支持AIS的诊断。ER特别是PR表达丢失支持AIS的诊断,而反应性增生性病变常阳性表达ER、PR。