肾母细胞瘤
Nephroblastoma
夏成青 赵明 程亮
发布时间:2016-04-03 07:22:34
同义词(或曾用名):Wilms瘤
概述:
发病部位:肾脏
诊断要点:
1.肾母细胞瘤在儿童中发病率约1/8000,首诊年龄在男性和女性分别为37个月和43个月, 98%的患者年龄小于10岁,成人少见;大多数病例为单发,少数可多发,5%累及双侧肾脏;
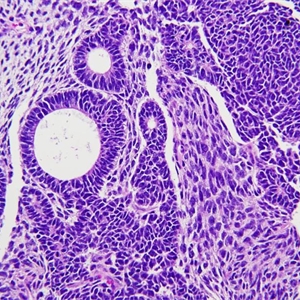
2.大体检查显示肾母细胞瘤多为圆形实性肿块,有纤维性假包膜,与周围肾实质分界清楚,切面实性,通常质地柔软,当间质成分为主时质地可较硬伴有旋涡状纹理,有时囊性变,偶尔可发生于肾外;
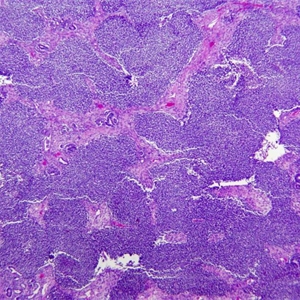
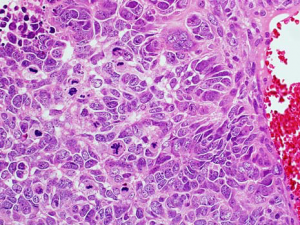
3.肾母细胞瘤多呈三相分化,由未分化的胚芽组织、多少不等的上皮成分和间叶成分组成,也可呈双相分化或单相分化病例;
4.胚芽细胞有几种生长排列方式:弥漫型,细胞缺乏黏附性,侵入周围结缔组织和血管,与大多数典型的肾母细胞瘤有假包膜包绕和推压式生长不同。结节状或蛇型的的胚芽细胞黏附性较好,在疏松的纤维黏液性间质中呈圆形或弯曲的界限清楚的条索状或巢状;
5.胚芽细胞体积小,圆形或椭圆形,胞浆稀少,核重叠,染色质略粗糙,均匀分布,可见小核仁,核分裂活跃;
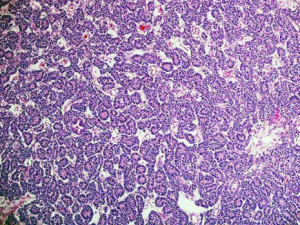
6.多数病例有上皮成分的分化,早期的小管类似于原始菊形团样结构,但大多数容易看到分化较好的小管或肾小球样结构,类似肾形成过程中不同阶段的改变;
7.可有异源性上皮分化,最常见的是黏液上皮和鳞状上皮;
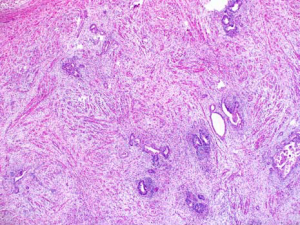
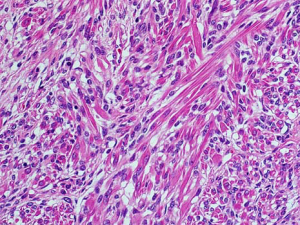
8.间叶成分多样,可有平滑肌、横纹肌和纤维母细胞的分化,横纹肌是最常见的异源性间叶性成分,有时可能构成肿瘤的大部分;其他间叶异源性成分包括脂肪组织、软骨、骨、神经节细胞和神经胶质;与叶内型肾源性残余相关的肾母细胞瘤常以间叶成分为主;当肾母细胞瘤缺乏胚芽组织和上皮分化时,诊断可能较困难。
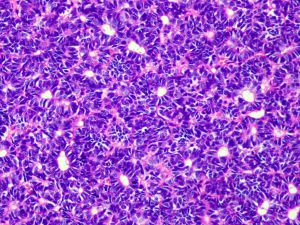
9.约5-8%的肾母细胞瘤显示间变,定义为肿瘤细胞具有大而浓染的核,多极核分裂象。间变的瘤细胞的核最大径3倍或以上于周围非间变的瘤细胞核的最大径。不典型核分裂象较大,每一极的臂比正常间期核分裂象的臂要大。间变罕见于2岁以内的肾母细胞瘤,但是5岁的肾母细胞瘤中间变的比例增高至13%。
附1.修订后SIOP肾母细胞瘤工作分类
A.治疗前病例
Ⅰ.低度危险肿瘤
部分囊状分化的肾母细胞瘤
完全坏死的肾母细胞瘤
Ⅱ.中度危险肿瘤
肾母细胞瘤——上皮型
肾母细胞瘤——间质型
肾母细胞瘤——混合型
肾母细胞瘤——消减型
肾母细胞瘤——灶状间变型
Ⅲ.高度危险肿瘤
肾母细胞瘤——胚芽型
肾母细胞瘤——弥漫间变型
B.原发的肾切除病例
Ⅰ.低度危险型
部分囊状分化的肾母细胞瘤
Ⅱ.中度危险肿瘤
非间变型肾母细胞瘤及其变异型
肾母细胞瘤——灶状间变
Ⅲ.高度危险肿瘤
肾母细胞瘤——弥漫间变
附2.化疗后改变
化疗可导致肿瘤坏死、黄瘤样细胞形成、含铁血黄素沉积和纤维化等改变,其他常见的改变还包括胚芽组织向较成熟的上皮、间叶成分和肌源性成分分化的特点。某些肿瘤化疗后完全坏死,提示该肿瘤对化疗敏感,手术后仅需最小量的辅助治疗。相反,那些对化疗无反应的肿瘤,预后差,手术后需加量辅助治疗。
间变
约有5%肾母细胞瘤细胞可发生间变.预后差。2岁以内的患儿罕见间变,而5岁者增至约13%。间变指征包括:细胞分裂加速、细胞核增大、染色质增多。间变的瘤细胞的细胞分裂速度大大超过非间变细胞。
间变的瘤细胞增殖分裂的速度较非间变细胞快,而且出现非正常的多极和多倍体核分裂。
间变瘤细胞的细胞核增大、染色质增多,最大径至少是非间变细胞的三倍。核增大指核三维直径均增大,而不仅仅是细胞变长。
瘤细胞间变被证实较瘤细胞浸润现象与治疗反应关系更密切。对化疗无反应的间变成分在术前治疗过程中不会消失,因而在术后标本中检出率高。当间变弥漫分布并出现于进展期病变中时,提示预后不好。病理观察要注意灶状间变和弥漫性间变之分,因为两者的治疗和预后也有所不同。灶状间指肾脏原发瘤中仅见一个或少数边界清楚的间变细胞聚集区。否则称弥漫性间变。
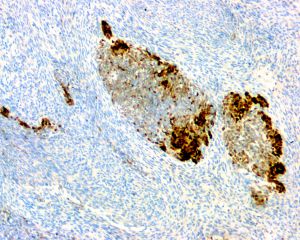
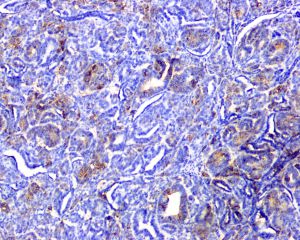
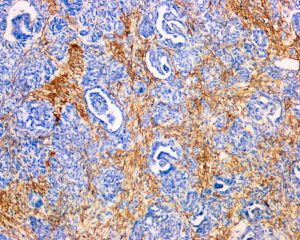
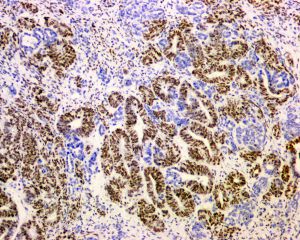
免疫组织化学染色:
分子标记:
鉴别诊断:
其他小蓝细胞肿瘤 真正管状腔隙的形成有助于诊断肾母细胞瘤,免疫标记(尤其小的活检标本)有助于鉴别肾母细胞瘤、横纹肌肉瘤及原始神经外胚层肿瘤。
非成熟畸胎瘤 需要与伴广泛异源性分化的肾母细胞瘤鉴别,畸胎瘤显示器官样分化(如:纤毛上皮伴平滑肌及软骨等)。
后肾腺瘤 需要与上皮成分为主的肾母细胞瘤鉴别, 胞核大小均一及无重叠,染色质细腻及核仁隐约可见,缺乏核分裂像,CD57及BRAF阳性等可与肾母细胞瘤鉴别。
乳头状肾细胞癌 需要与伴乳头区域的上皮成分为主的肾母细胞瘤鉴别,乳头状肾细胞癌(RCC)常伴泡沫状巨噬细胞,常伴更高级别的细胞学改变(包括显著核仁),AMACR及CK7弥漫性强阳性,WT1阴性。
预后:
治疗:
参考文献:
Immunohistochem Mol Morphol. 2008;16:128–134.
Zin RM, Murch A, Carles A. Pathology, genetics and cytogenetics of Wilms’ tumour. Pathology. 2011;43:302–312.