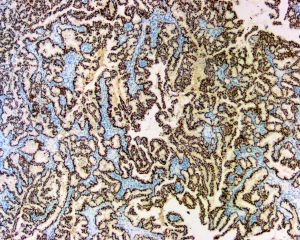
几乎全部阳性(≥95%的病例阳性):
Collagen IV、VEGF、E-cadherin通常阳性(<95%,≥75%的病例阳性):
P63、PRP、SMHC、Calponin经常阳性(<75%,≥55%的病例阳性):
TGF-beta-1少数阳性(<35%,≥15%的病例阳性):
34bE12偶尔阳性(<15%,≥5%的病例阳性):
CD10几乎全部阴性(<5%的病例阳性):
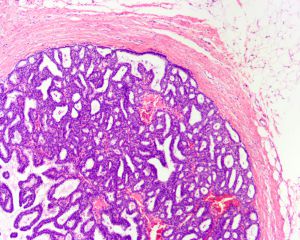
HER21. 大体检查肿瘤位于囊腔内,常借助宽的基底与囊壁相连,囊内积液可使囊腔扩张;
2. 低倍镜下表现为乳头状增生性病变被一层厚纤维被膜包绕;
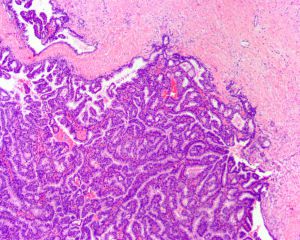
3. 乳头状结构纤细,一般仅有薄的纤维血管轴心,上皮细胞增生明显时乳头状结构可不明显,但能见到明显的纤维血管间隔;
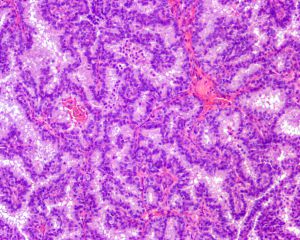
4. 肿瘤可显示为蓬乱分支乳头状结构,筛孔状结构,或实性致密团块;
5. 个别病例可有囊内肿瘤坏死;
6. 肿瘤上皮细胞形态单一,常为复层柱状上皮,具有低级别或中级别核异型,偶尔显示高级别核;
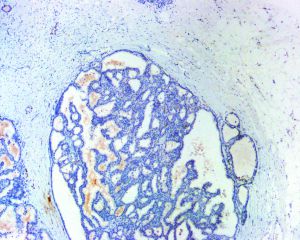
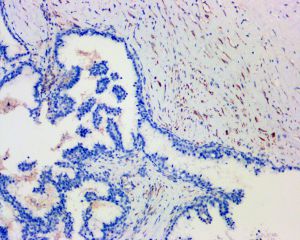
7. 乳头内及管腔周围均无肌上皮细胞;
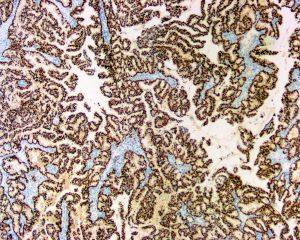
8. collagenⅣ和laminin染色,可证实基底膜存在;
9. 纤维包膜内可见埋陷的肿瘤上皮或肿瘤细胞浸润包膜,在这种情况下,不能诊断为间质浸润,只有当癌细胞病灶出现在纤维被膜外时,才能确定为浸润性癌,浸润癌的形态常表现为非特指型浸润性癌;伴有高级别核的包裹性乳头状癌常见病灶周边的浸润灶。
10. 乳头状结构及其累及的囊腔周围肌上皮细胞免疫标记物(p63、平滑肌肌球蛋白重链、calponin等)阴性;肿瘤细胞一般不表达高分子量角蛋白(CK5/6)。
注意:
1. 如果细胞核具多形性和核分裂活跃,且/或HER2阳性或三阴性,则应作为浸润性乳腺癌进行分级、分期和治疗。
2. ER、PR和ERBB2 (HER2)的评估应仅评估浸润性成分。
1.导管内乳头状瘤:属良性病变,导管上皮细胞可有不同程度的增生,但增生的细胞无异型性。
2.非典型乳头状瘤:乳头状瘤内局部导管上皮有不典型细胞增生,与ADH相似。
3.乳头状瘤伴导管原位癌:具有非典型导管增生局部区域大于或等于整个病变的三分之一或大于3mm。这种病变非常少见。最好诊断为非典型乳头状瘤。
4.导管内乳头状癌:导管内乳头状癌累及管腔周围存在肌上皮细胞,包裹性乳头状癌的管腔周围无肌上皮细胞。肌上皮细胞标记物(p63、平滑肌肌球蛋白重链、CD1O、calponin等)免疫组化染色可证实肌上皮细胞的存在与否。
5.浸润性乳头状癌:当浸润性病灶出现在纤维包膜外时,可以确诊为浸润性癌。p63蛋白和肌球蛋白重链等肌上皮细胞标记物阴性的免疫组化染色可以证实浸润性病灶的存在。
Collins LC, Carlo VP, Hwang H, Barry TS, Gown AM, Schnitt SJ. Intracystic papillary carcinomas of the breast: a reevaluation using a panel of myoepithelial cell markers. Am J Surg Pathol. 2006;30(8):1002‐1007.
Douglas-Jones AG, Verghese A. Diagnostic difficulty arising from displaced epithelium after core biopsy in intracystic papillary lesions of the breast. J Clin Pathol. 2002;55(10):780‐783.
Esposito NN, Dabbs DJ, Bhargava R. Are encapsulated papillary carcinomas of the breast in situ or invasive? A basement membrane study of 27 cases. Am J Clin Pathol. 2009;131(2):228‐242.
Hill CB, Yeh IT. Myoepithelial cell staining patterns of papillary breast lesions: from intraductal papillomas to invasive papillary carcinomas. Am J Clin Pathol. 2005;123(1):36‐44.