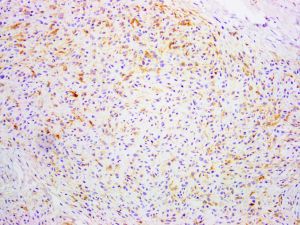
几乎全部阳性(≥95%的病例阳性):
CD68、Vimentin通常阳性(<95%,≥75%的病例阳性):
FVIIIA、FXIIIA、ALK1经常阳性(<75%,≥55%的病例阳性):
CD163偶尔阳性(<15%,≥5%的病例阳性):
CD10、S100几乎全部阴性(<5%的病例阳性):
AE1/AE3、CD63、CD64、CK-PAN、FVIII、FVIIIRAg、melan-A、Tyrosinase、ULEX - 1、CD31、CD34、Desmin、HMB45、SMA1. 罕见,占所有皮肤纤维组织细胞瘤的比例不超过2%,发病高峰年龄50岁,也可发送于年轻人,男性略多见;
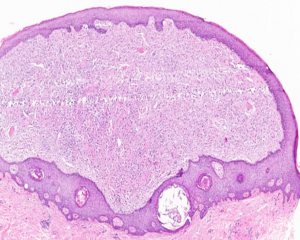
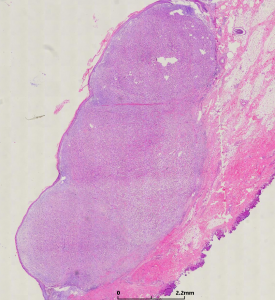
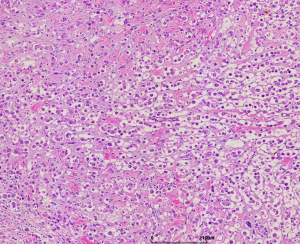
2.大体上肿瘤的界限较清楚,呈肉色的半圆形或息肉样,其长轴常与表皮平行,瘤体直径0.2-2.0cm;
3. 镜下低倍镜下表现为息肉状凸起,两侧可见表皮呈衣领状改变,病变主要位于真皮层,仅有局灶的皮下组织或脂肪累及;
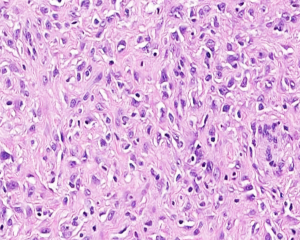
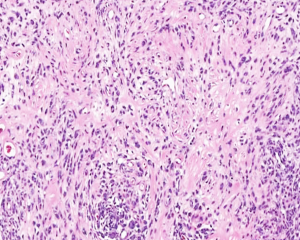
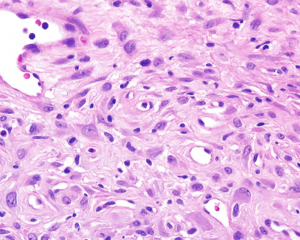
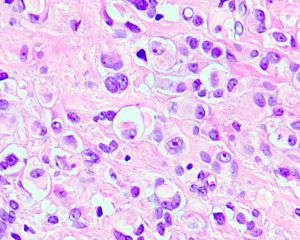
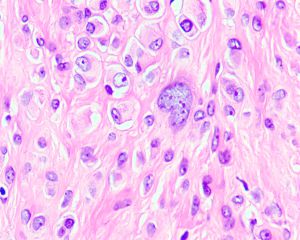
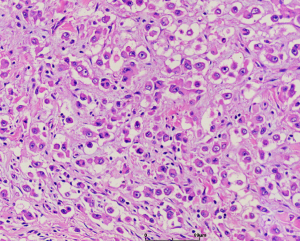
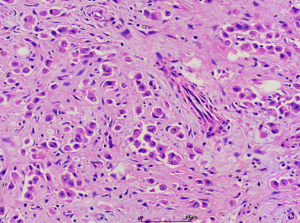
4. 构成肿瘤的主体为实性成片的圆形的上皮样肿瘤细胞(>50%),核圆形或卵圆形伴有空泡状染色质和小的嗜酸性核仁,可见多少不等的双核或三核细胞,核分裂象稀少;部分为梭形细胞,可见席纹状排列;极少见的情况下可以梭形细胞为主或表现为颗粒状胞浆;
5. 间质为稀少的胶原性间质伴有较丰富的血管,局部可见上皮样肿瘤细胞围绕血管生长或形成模糊的旋涡;较长期的病变可见明显的间质玻璃样变性;常见局灶的毛细血管扩张充血和黏液变性;偶见类似于软骨母细胞瘤样的纤细的围绕瘤细胞的钙化;
6. 被覆表皮常见表现为增生或棘皮瘤样改变;
7. 多核巨细胞和含铁血黄素相对少见,可见少量的淋巴浆细胞以及肥大细胞浸润。
Spitz痣:可完全位于真皮内,尽管大多数存在表皮和真皮交界处的肿瘤成分,肿瘤细胞以巢状生长为主,可见特征性的Kamino小体
恶性黑色素瘤:明显的核多形性,活跃的核分裂象,表达S100蛋白和黑色素标志物;
上皮样肉瘤:相对部位较深,细胞的非典型性相对较明显,可见肿瘤性坏死或渐进性坏死,免疫组化染色表达CK,半数表达CD34,90%以上显示INI1表达缺失;
网状纤维组织细胞瘤:可见大的多核细胞伴有玻璃样的嗜酸性胞浆和胞浆收缩现象;
幼年性黄色肉芽肿:可见典型的脂化细胞和较多的慢性炎细胞浸润;
化脓性肉芽肿(毛细血管瘤):可与早期富于血管化间质的上皮样纤维组织细胞瘤混淆,毛细血管瘤为内皮细胞肿瘤;
非神经源性的颗粒细胞瘤:与伴有颗粒细胞胞浆的上皮样纤维组织细胞瘤具有相似的临床和组织学特征以及遗传学特征,提示两者可能是一组密切相关的肿瘤;
其他类型的良性纤维组织细胞瘤:以梭形细胞构成为主,伴有明显的席纹状结构,肿瘤的周边常见内陷的真皮固有胶原纤维,多核巨细胞和泡沫样组织细胞以及含铁血黄素沉积更常见,不表达EMA,无ALK基因重排;这些证据提示上皮样纤维组织细胞瘤可能是不同于普通的皮肤纤维组织细胞瘤的另一类独特的实体性肿瘤;
合体细胞肌上皮瘤:与上皮性纤维组织细胞瘤具有相似的组织学特征,合体细胞肌上皮瘤表达EMA和CK,不同程度表达S100蛋白和SOX10,不表达ALK,遗传学表现为EWSR1重排可资鉴别。
惰性进程,罕见复发,无转移倾向
完整切除
Gomez CS, Calonje E, Fletcher CD. Epithelioid benign fibrous histiocytoma of skin: clinico-pathological analysis of 20 cases of a poorly known variant. Histopathology. 1994;24:123–129
Doyle LA, Mariño-Enriquez A, Fletcher CD, et al. ALK rearrangement and overexpression in epithelioid fibrous histiocytoma. Mod Pathol. 2015;28:904.
Dickson BC, Swanson D, Charames GS, et al. Epithelioid fibrous histiocytoma: molecular characterization of ALK fusion partners in 23 cases. Mod Pathol. 2018;31:753–762.
Kazakov DV, Kyrpychova L, Martinek P, et al. ALK gene fusions in epithelioid fibrous histiocytoma: a study of 14 cases, with new histopathological findings. Am J Dermatopathol. 2018:1–10.
Doyle LA, Fletcher CD. EMA positivity in epithelioid fibrous histiocytoma: a potential diagnostic pitfall. J Cutan Pathol. 2011;38:697–703.
Cohen J N , Yeh I , Jordan R C , et al. Cutaneous Non-Neural Granular Cell Tumors Harbor Recurrent ALK Gene Fusions[J]. Am J Surg Pathol 2018;42(9):1133–1142