前列腺导管内癌
Prostate Intraductal Carcinoma
夏成青 赵明 程亮
发布时间:2016-04-11 07:04:54
概述:
发病部位:前列腺
诊断要点:
前列腺导管内癌(IDC-P)是近年才阐明的一种具有独特临床病理特征的前列腺癌实体病变,泌尿病理医师以及泌尿外科医师对该病变都还不甚了解。IDC-P最先由Rhamy在1972年提出,但当时并没有形成统一的诊断标准,而且其中可能包括了许多现在称之为导管腺癌的病变。随后的研究对该病变提出了较为明确的定义,即浸润性癌在前列腺正常腺体结构内的扩散从而导致恶性肿瘤细胞在导管和腺泡内的腔内增殖,并进一步证实IDC-P与Gleason分级高、肿瘤体积大的侵袭性前列腺癌存在明显的相关性。
一、 组织学改变
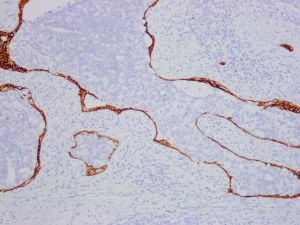
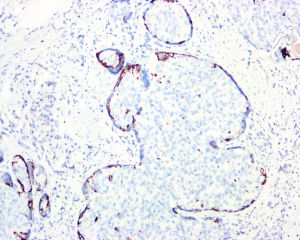
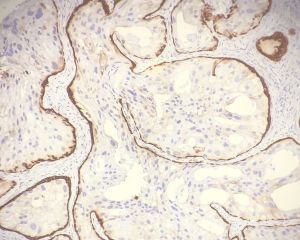
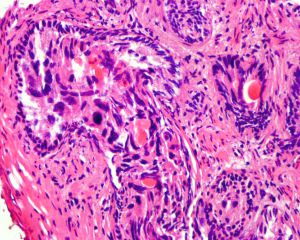
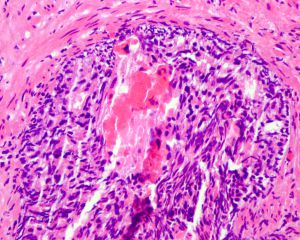
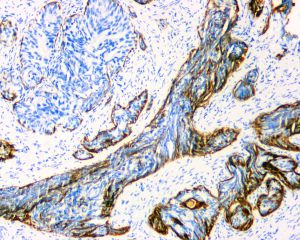
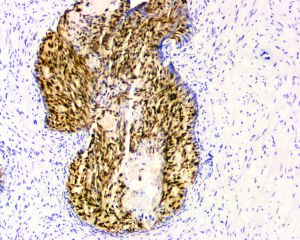
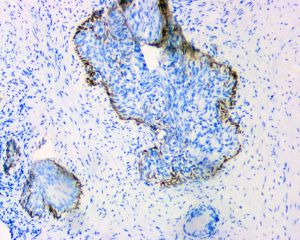
IDC-P的组织学特征为癌细胞在前列腺固有腺体内膨胀性增生并至少局灶保存有基底细胞。
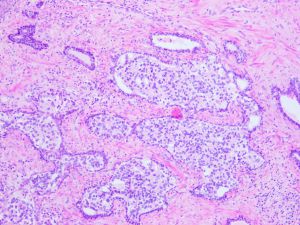
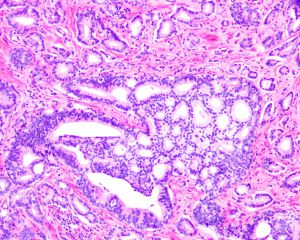
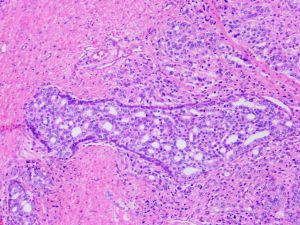
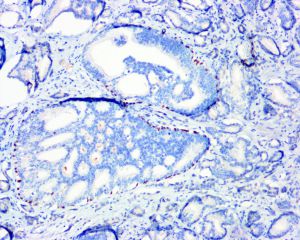
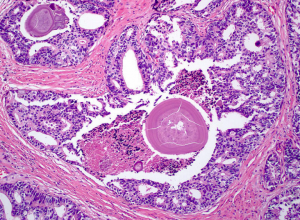
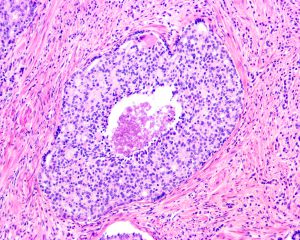
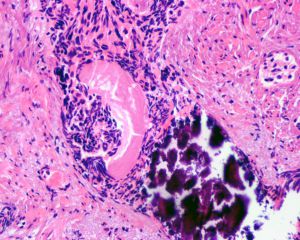
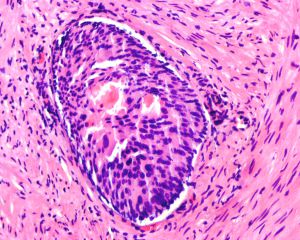
在IDC-P的前列腺根治切除标本中,一般至少存在6个以上的IDC-P腺体,肿瘤腺体的直径一般为邻近正常的外周带腺体大小的2倍或以上,常显示不规则的分枝状轮廓。IDC-P存在几种组织学生长方式,(1)疏松筛状结构,2个细胞厚度的细胞条带相互交错,填充腔面,在周围形成花边状的空腔,无支持性间质;(2)微乳头状结构,增生的细胞簇无明显的纤维血管轴心;(3)致密筛状结构,小而圆的凿除状规则腔隙不超过腺腔面积的50%;(4)实性膨胀性结构。被覆上皮立方状或矮柱状,具有明显的细胞异型性和核的多形性,有时核的大小是邻近良性前列腺细胞核大小的6倍以上,常见粉刺样坏死(图1-4)。
前列腺穿刺活检标本中IDC-P的诊断标准,诊断IDC-P需要存在(1)实性或密集的筛状结构,其中凿除状规则的空腔不超过腺腔面积的50%;或(2)明显的核异型性,肿瘤细胞核的大小至少超过邻近的良性腺体细胞核的6倍;或(3)非局灶性的粉刺样坏死。当鉴别诊断为HGPIN和IDC-P时,病变如果没有满足IDC-P的诊断标准但不典型性较HPGIN显著,则诊断为非典型导管内上皮增生(atypical intraductal proliferations)。
大多数情况下,IDC-P常伴随浸润性癌存在,这些癌通常是Gleason 分级4或5。这种情况下,报告IDC-P的意义还存有争议。但是基于其可能提供的其他预后信息,还是推荐在病理报告中指出IDC-P。罕见情况下,IDC-P可存在于仅有Gleason 分级3的前列腺癌穿刺活检标本中。IDC-P需要在报告中指出,可通过两种方式说明:其一,IDC-P可被认为是浸润性癌或与浸润性癌一样分级(Gleason 4或5,如果存在实性结构和/或坏死即为5分,如果没有则是4分)。另外,仅将浸润性癌分级, 并在备注中指出存在IDC-P及其临床意义。当在穿刺活检中仅发现IDC-P而无伴随的癌的时候,此时不需要对IDC-P分级,但需要报告IDC-P并在备注中阐明IDC-P通常与高级别的、高肿瘤容积的前列腺癌有关,指出患者需要明确的治疗。
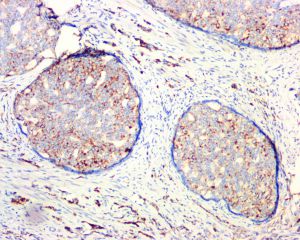
免疫组织化学染色:
鉴别诊断:
1.筛状高级别前列腺上皮内肿瘤:在前列腺穿刺活检标本中,鉴别孤立性的IDC-P与筛状HGPIN具有重要的临床意义,因为这两类病变在临床处理上具有明显的区别。尽管两者均可表现为导管和腺泡内的不典型或恶性上皮增生,但IDC-P的细胞和结构的异型性更显著,而筛状HGPIN的腺体较小,外形圆而平滑,瘤细胞相对较一致,无明显的多形性和坏死。HGPIN和IDC-P均可见到疏松的筛状和微乳头状结构,但致密的筛状和实性生长方式以及粉刺样坏死几乎从不出现于HGPIN中。在疏松的筛状和微乳头状结构中诊断IDC-P需要存在其他的细胞学特征,如明显增大的、多形性核(至少6倍大小于邻近的非肿瘤性腺体的核)以及非局灶性的粉刺样坏死。HGPIN与IDC-P具有相似的免疫表型特征,包括表达PSA、甲酰基辅酶A消旋酶(AMACR)以及基底细胞标志物,因此应用这些常规的免疫染色对于鉴别两者并没有帮助。最近Loton等[22]在一项应用免疫组织化学染色鉴别IDC-P和HGPIN的研究中发现,84%的IDC-P以及100%的筛状IDC-P存在胞质人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)的表达缺失(绝大多数表现为均质性的胞浆表达缺失),IDC-P与其相关的浸润性癌PTEN表达模式的一致性超过95%,而所有的HGPIN均无PTEN的胞质表达缺失,这一研究结论提示PTEN表达缺失可作为鉴别IDC-P与HGPIN有用的免疫组织化学标志物,并进一步解释IDC-P与预后不良之间的潜在分子机制。支持将IDC-P归类为独立的实体病变的分子遗传学证据,来自于对前列腺癌的微卫星灶的杂合性缺失(LOH)评估的研究。研究发现29%的Gleason 4的前列腺癌和60%的IDC-P显示LOH,但在前列腺上皮内瘤变(PIN)和Gleason 3的腺癌中却很少观察到LOH。此外,IDC-P存在等位基因不稳定性可明显将其与HGPIN区分开来,特别是IDC-P中分子异常的数量和发生频率明显高于HGPIN,提示前者在恶性程度上是明显高于HGPIN的一种进展性病变。尽管在大多数的情况下,应用上述的形态学标准能够可靠的鉴别IDC-P与HGPIN,但有些IDC-P在形态上可与HGPIN存在重叠。在某些混杂于前列腺癌中,具有TMPRSS2-ERG基因融合(一种前列腺癌高度特异性的遗传学异常)的IDC-P腺体在结构和细胞特征上类似于远离癌组织的,无TMPRSS2-ERG前列腺癌特异性基因融合的HGPIN,两者均由圆而平滑的小筛状腺体构成,衬里为低核级的细胞。这些研究表明IDC-P偶尔可表现为低级别形态学特征而与HGPIN存在明显的组织学相似性,并不满足通常所应用的IDC-P诊断标准。因此,在穿刺活检标本中无浸润性癌的情况下,ERG基因重排可帮助鉴别这些形态学诊断困难的IDC-P和HGPIN,如果检测到ERG基因重排意味着肿瘤内存在未被取样的浸润性癌,高度提示该病变为IDC-P,而目前还没有报道表明无浸润性癌的孤立性HGPIN中存在这一基因异常。另一方面,任何筛状或腔面膨胀性增生的不典型病变都可能是IDC-P,当其出现在前列腺穿刺活检中时值得进行进一步的处理。
2.浸润性筛状腺泡性腺癌:浸润性筛状腺泡性腺癌(通常是Gleason 4分,如果存在粉刺样坏死则是5分)与筛状IDC-P存在明显的组织学相似性。与IDC-P不同,浸润性筛状癌周围无基底细胞围绕。在某些情况下,识别正常导管轮廓和分支有助于区分IDC-P与浸润性筛状癌;此外,后者通常存在腺体的融合,而IDC-P则缺乏这一特征。如果不做基底细胞的免疫组织化学染色的话,那么大多数的IDC-P将可能诊断为筛状腺泡性腺癌。然而,鉴别浸润性高级别前列腺癌与IDC-P有时可能并不那么重要,因为IDC-P几乎总是伴随有Gleason分级较高、肿瘤容积较大的浸润性癌。尽管如此,有研究表明在病理报告中指出IDC-P的重要性,因为其与疾病加速进展的高危险性有关。
3.前列腺导管腺癌:导管腺癌是一种侵袭性的前列腺癌,起源并生长于前列腺尿道及尿道周围的导管内,偶尔可起源于周围带的腺体。大多数情况下,导管腺癌常伴随有侵袭性腺泡性腺癌但偶尔也可以单独存在。典型的导管腺癌组织学上表现为高柱状的假复层上皮排列成筛状结构伴有裂隙状腔隙和/或真性乳头形成,类似于子宫内膜样腺癌,其他的生长方式包括筛状、腺样或PIN样。导管腺癌的乳头具有真性的纤维血管轴心,被覆上皮可能具有明显的核异型性,以及较高的核分裂象和广泛的坏死;瘤细胞核大,多数为伸展的或卵圆形的,常含有单个的巨核仁。与之相反,IDC-P的肿瘤细胞为立方形,筛状结构的腔缘较圆,微乳头状细胞簇无纤维血管轴心。与其他高级别前列腺癌一样,导管腺癌也易于出现导管内扩散。因此在导管腺癌周围通常可发现残存的基底细胞。从概念上来讲,导管腺癌伴有基底细胞就是IDC-P,提出将导管腺癌分类到IDC-P的范畴内。但是基于IDC-P特征性的形态学表现以及并不是所有的导管腺癌周围都存在基底细胞,因此前列腺导管腺癌与导管内癌并不是同一个概念。
4.尿路上皮癌累及前列腺:原发于膀胱的或者是罕见的情况下前列腺原发的尿路上皮癌,可扩散至前列腺导管内填充导管腔并可能伴有坏死,在形态上与实性IDC-P非常相似。然而,与IDC-P相比,尿路上皮癌的肿瘤细胞的多形性更显著,胞质更致密而粉染。在诊断困难的情况下,利用免疫组织化学染色可帮助区分两者。IDC-P表达前列腺特异性标志物如PSA、前列腺特异性酸性磷酸酶(PSAP)、前列腺特异性膜抗原(PSMA),而基底细胞标志物(CK5/6、34BE12、p63等)只着染肿瘤腺体周围的基底细胞。相反,尿路上皮癌不表达PSA,大多数表达34βE12和p63。需要注意的是,常用于诊断前列腺癌的标志物AMACR在许多高级别尿路上皮癌中也可表达,因此应用这一免疫标志物进行鉴别诊断时需要谨慎。
5.转移性腺癌:前列腺转移性腺癌,特别是来自于结直肠的腺癌,可表现为筛状结构伴有粉刺样坏死从而与IDC-P造成混淆。在常规组织切片中,存在“污秽”的坏死,柱状肿瘤细胞伴有位于基底部的核以及黏液分泌提示肿瘤肠源性起源的可能。结合临床病史以及免疫组织化学染色(CDX-2、CK20、β连环蛋白)有助于正确的诊断。
治疗:
参考文献:
Montironi R, Scarpelli M, Cheng L, et al. Do not misinterpret intraductal carcinoma of the prostate as high-grade prostatic intraepithelial neoplasia! Eur Urol,2012,62(3):518-522.
程亮, 赵明. 前列腺导管内癌:诊断标准及鉴别诊断. 中华病理学杂志.2014;43(3):199-202.
Epstein J I, Egevad L, Amin M B, et al. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System [J]. Am J Surg Pathol, 2016, 40(2): 244-52.