脑膜瘤
Meningioma
夏成青
发布时间:2017-07-24 14:25:45
概述:
脑膜瘤包括一个肿瘤家族,常位于硬脑膜,最有可能来源于蛛网膜的脑膜上皮细胞,CNS WHO分级1、2或3级。
发病部位:颅内最常见于大脑镰部、大脑凸面、嗅沟、蝶骨嵴、鞍结节及蝶鞍旁区,亦可见于脑室内、松果体区、颅后窝及椎管内等。
诊断要点:
临床特征
1. 在美国,脑膜瘤的年龄调整后年平均发病率为每10万人8.58例,占中枢神经系统肿瘤的37.6%。
2. 它是成人中最常见的原发性脑肿瘤,但在0-19岁的儿童中最不常见。险随着年龄的增长发病率增加;诊断时的中位年龄为66岁。
3. 在所有年龄段中,女性1级脑膜瘤的发病率是男性的2.32倍,绝经前风险差异最大(3.28),绝经后降低。
4. 脑膜瘤通常发生在颅内、椎管内或眶内。最常见的部位包括脑凸(肿瘤常位于枢椎旁,与大脑镰和/或静脉窦有关)、嗅沟、蝶嵴、鞍旁/鞍上区、视神经鞘、岩脊、幕和后窝,脑室内和硬膜外不常见。大多数脊膜瘤发生在胸椎区域。
5. 肿瘤位置与突变谱密切相关:凸面脑膜瘤和大多数脊髓脑膜瘤通常携带22q缺失和/或NF2突变,而颅底脑膜瘤携带AKT1、TRAF7、SMO和/或PIK3CA 变异。较高级别的脑膜瘤最常发生在突起和其他非颅底部位。罕见的原发性脑膜瘤发生在神经轴外(如肺)。
6. 脑膜瘤通常生长缓慢,随肿瘤位置的不同而发生神经功能缺损。临床体征和症状可由邻近结构受压引起。头痛、虚弱和癫痫是常见的,尽管脑膜瘤不是特征性的。更高级别的肿瘤和具有攻击性行为分子生物标志物的肿瘤进展更快。
影像学特征:1. 脑膜瘤在MRI上表现为等密度、均匀增强的硬脑膜肿块。钙化很常见,在CT上表现最好。
2. 一个常见的影像学特征是肿瘤周围的硬脑膜尾部增强,通常与反应性纤维血管组织相对应,但不一定预测硬脑膜受累。
3. 某些组织学亚型中肿瘤周围脑水肿突出,如分泌性脑膜瘤、血管瘤/微囊性脑膜瘤、淋巴浆细胞丰富脑膜瘤和高级别脑膜瘤。
4. 脑膜瘤内部或周围可有囊肿形成,钆增强MRI的定量和定性成像特征可以提示脑膜瘤的组织学分级,并更可能预测患者的预后。
播散1. 脑膜瘤通常侵入邻近的解剖结构(尤其是硬脑膜),尽管在更具侵袭性的亚型中,局部扩散的速度和范围往往更大。
2. 颅外转移(如肺、胸膜、骨和/或肝脏)是罕见的,最常与中枢神经系统WHO 3级脑膜瘤相关。
3. 在一个系列中,所有脑膜瘤的转移率为0.67%,CNS WHO 2级脑膜瘤(2%)和3级脑膜瘤(9%)的转移率更高。
大体特征
1. 脑膜瘤通常呈边界清楚的实心球形肿块,有广泛的硬脑膜附着。有的呈分叶状或双叶状,有的呈扁平、地毯状、斑状,如沿蝶骨硬脑膜生长的。
2. 脑膜瘤坚硬,呈橡胶状,有时呈胶状或囊状。
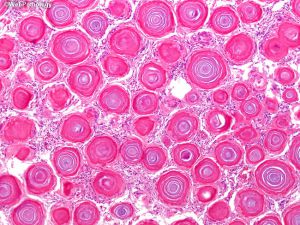
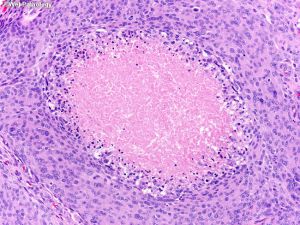
3. 一些脑膜瘤,特别是脊髓砂砾体型,由于沙粒体丰富,可具有砂砾感;纤维型可以有光滑的表面。
4. 大多数1级脑膜瘤压迫邻近的大脑,但不粘附或侵袭脑组织,可以很容易地与大脑分离。然而,高级别脑膜瘤可以广泛粘附和侵袭,也可能以坏死区域为特征。
5. 脑膜瘤也可侵犯硬脑膜窦,如矢状旁脑膜瘤可部分或完全阻塞上矢状窦。
6. 偶尔,脑膜瘤侵入颅骨并诱发反应性骨质增生,如颅骨穹窿、蝶骨或眶骨。
7. 脑膜瘤也可附着或包裹脑动脉和/或脑神经,但很少浸润这些结构。
它们可通过头盖骨渗入头皮和皮肤的软组织,并进入颅外腔室,如眼眶。
3. 组织学特点(详见相关章节):
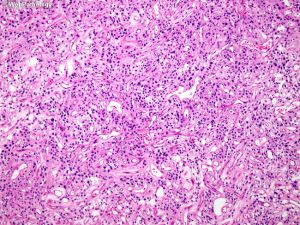
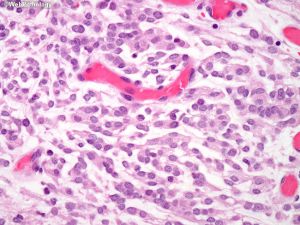
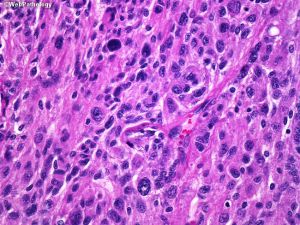
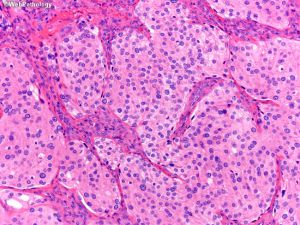
(1)脑膜上皮型:细胞叶状分布,胞浆丰富及胞界不清(合胞体样),核内假包涵体,胞核均匀浅灰色;
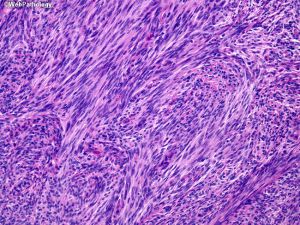
(2)纤维型:梭形细胞簇状分布,不定程度的胶原及网状蛋白成分,线状间质钙化;
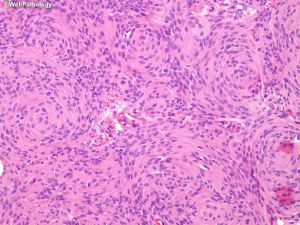
(3)过渡型:可见混合性脑膜上皮及纤维性结构,常见漩涡状及砂砾体;
(4)砂砾体型:可见大量砂砾体,部分出现少量脑膜上皮细胞;
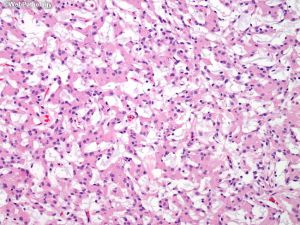
(5)血管瘤型:可见大量血管,大的厚壁血管类似血管畸形,血管壁玻璃样变,小血管类似血管母细胞瘤;
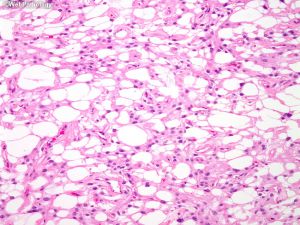
(6)微囊型:常见与脑组织黏附,细胞之间质地疏松,微囊形成,局灶或经典脑膜瘤样区域,可见泡沫细胞,核多形性及散在细胞,类似血管母细胞瘤,出现增厚血管玻璃样变;
(7)分泌型:脑膜上皮细胞中可见假砂砾体,小的嗜酸性球体,有时单细胞中可见多个;
(8)淋巴浆细胞丰富型:伴大量慢性炎症,可见浆细胞伴Russell小体;
(9) 化生型:无单一组织学类型,可见脂肪瘤样、黄色瘤样、软骨样、黏液样或骨样,脂肪瘤样类似正常脂肪组织;
(10)脊索样脑膜瘤(WHO II级):上皮样、脊索瘤样形成,脊索瘤样比例要求没有统一的定论,常与普通脑膜瘤相关;
(11)透明细胞型(WHO II级):细胞呈单形性,胞浆透亮、PAS阳性及富于糖原,少数或见旋涡状,无砂砾小体或核包涵体;
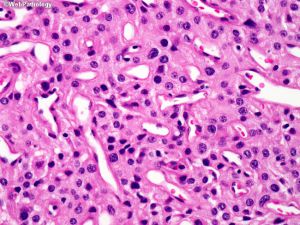
(12)横纹肌样型:可见偏心性胞核及显著核仁,嗜酸性胞浆核旁漩涡状,Ki67标记指数偏高,常与普通脑膜瘤相关,无不典型性及核分裂;
(13) 乳头状:可见血管周围假菊形团形成,常与不典型脑膜成分相关,有时与横纹肌样结构相关。
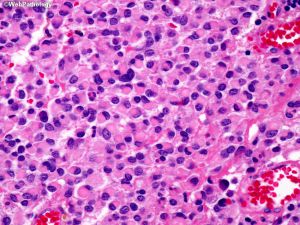
(14)非典型脑膜瘤:至少具有以5种形态学特征中的3种:高细胞密度,高N:C比的小细胞,突出的核仁,片状(不间断的无模式或片状生长)和自发(非医疗源性)坏死灶。
(15)间变性(恶性)脑膜瘤:具有明显的恶性细胞形态(间变性),可以(1)类似于癌、高级别肉瘤或黑色素瘤;(2)有丝分裂活性明显升高;(3)携带TERT启动子突变;和/或(4)CDKN2A和/或CDKN2B纯合缺失
(16)其他组织病理学模式:以上所涵盖的大量亚型已经说明了脑膜瘤的广泛形态谱。然而,脑膜瘤可以有多种形态特征,甚至超过那些已建立的亚型。这些脑膜瘤包括嗜酸细胞性、黏液性、硬化性、轮状硬化性、表达GFAP和颗粒丝状包涵体特征,或出现脑膜上皮菊型团。这些模式是罕见的,而且生物学和临床相关性的数据也太少,无法确定任何相关的含义。
诊断标准:
基本条件
典型的组织病理学特征符合至少一种脑膜瘤亚型
或
提示性组织病理学特征伴有NF2双等位基因失活或其他经典脑膜瘤(TRAF7、AKT1、KLF4、SMO、PIK3CA)、透明细胞脑膜瘤(SMARCE1)或横纹肌脑膜瘤(BAP1)的驱动基因突变
或
提示组织病理学特征符合特定脑膜瘤DNA甲基化分类之一
理想条件:
发生于脑膜部位
EMA免疫组化染色阳性
SSTR2A免疫组化染色弥漫性强阳性
NF2突变脑膜瘤的典型拷贝数改变,如低级别脑膜瘤中的22/22q单体,在高级别脑膜瘤中额外1p、6、10q、14q和/或18缺失
CNS WHO分级:
大多数脑膜瘤为良性,CNS WHO分级为1级。然而,在任何这些形态模式中都可能出现更具侵略性的生长特征。虽然乳头状和横纹肌样特征经常与其他侵袭性特征合并出现,但最近的研究表明,CNS WHO分级应根据CNS WHO 2级非典型或CNS WHO 3级间变性脑膜瘤的标准来确定,而不是仅根据横纹肌样或乳头状组织学来确定。将脑膜瘤划分为CNS 2级和3级的标准如下。这些标准可适用于所有脑膜瘤亚型,但诊断非典型脑膜瘤必须符合CNS WHO 2级标准,诊断间变性(恶性)脑膜瘤必须符合CNS WHO 3级标准:
CNS WHO 2级
连续10个HPF(0.16 mm2,至少2.5/mm2)4 ~ 19个有丝分裂象
或
明确的脑侵犯(不只是血管周围扩散或脑凹痕,无颅底破裂)
或
特定形态亚型(脊索状或透明细胞)
或
至少具备下列三项形态学特征:
·细胞密度增大
·小细胞且N:C比高
·核仁突出
·片状(不间断弥漫或片状生长)
·自发性(非医源性)坏死灶
CNS WHO 3级
连续10个HPF(0.16 mm2,至少2.5/mm2)≥20个有丝分裂象
或
明显的间变(肉瘤、癌或黑色素瘤样外观)
或
TERT启动子突变
或
CDKN2A和/或CDKN2B的纯合缺失
免疫组织化学染色:
分子标记:
1. 22号染色体单体是脑膜瘤中最常见的遗传异常,与>50%的肿瘤显示位于22q12.2编码NF2的等位基因缺失。高级别脑膜瘤表现出更复杂的遗传变化,1p、6p/q、10q、14q和18p/q缺失,2p/q、3p、4p/q、7p和8p/q缺失(较少见),以及CDKN2A和/或CDKN2B的杂合或纯合缺失。染色体臂的增益不常见,多见于血管瘤、化生和微囊性脑膜瘤。
2. 脑膜瘤的第一个亚群由NF2突变和22号染色体缺失定义。第二个亚群缺乏NF2突变,其特征是重现性AKT1 p.E17K致癌突变,以及TRAF7、KLF4、SMO或PIK3CA的改变。YAP1的改变主要发生在没有NF2突变的儿童脑膜瘤亚群中,可能导致Hippo通路的激活。
3. 遗传改变(如AKT1, SMO, PIK3CA)与脑膜瘤亚型密切相关,但不是亚型分类的唯一指标。
4. 大多数与亚型和分级直接相关的遗传改变(包括TERT启动子、SMARCE1、KLF4和TRAF7等改变)可以通过DNA测序来评估。由于TERT突变可能在进展过程中出现,因此选择用于DNA提取的组织应集中在最恶性和增生热点区域。
5. CDKN2A和/或CDKN2B的纯合缺失可以通过原位杂交评估或通过各种高通量测序或杂交分析计算;但是FISH探针很大,因此这种技术有时会遗漏小的缺失。
6. 在某些情况下,通过基因融合激活TERT或涉及YAP1的基因融合等罕见事件可以从高分辨率拷贝数图中推断出来,但它们通常只能通过RNA测序或原位杂交来证明。
7. BAP1和PBRM1可能发生突变或缺失,因此需要DNA测序。免疫组织化学染色可用于检测一些遗传改变,包括SMARCE1丢失(透明细胞脑膜瘤),BAP1丢失(横纹肌样脑膜瘤),或翻译后修饰,包括H3 p.K28me3 (K27me3)状态(三甲基化在侵袭性脑膜瘤亚群中丢失)。
8. 在组织学上具有挑战性的病例可以通过甲基化组分析提供关于肿瘤类型的信息,并定义表观遗传亚群;此外,拷贝数的改变被报道与DNA甲基化结果平行。
鉴别诊断:
1. 脑膜上皮增生:邻近出血、炎症可促进上皮增生,呈小的脑膜上皮细胞肿块样病变。
2. 神经鞘瘤 :致密区域(Antoni A)与疏松区域(Antoni B )交替出现及棒状胞核,S100(+)、EMA(-)及SSTR2A(-),细胞周围的胶原IV型及网状蛋白阳性等可与脑膜瘤鉴别。
。
3. 脊索瘤:中线分布,可见骨破坏及空泡细胞,Brachyury (+)、keratin (+)及EMA(+),S100阳性及阴性。
4. 血管母细胞瘤:无漩涡状及砂砾小体,网状亚型可见广泛网状蛋白,间质细胞Inhibin-α阳性,少数EMA阳性。
5. 黑色素细胞瘤:巢状结构及不同程度黑色素,HMB-45(+)、Melan-A(+)、S100(+)及 SOX10(+),EMA(-)。
6. 脑膜血管瘤病:皮质内斑块样,大量内陷的脑组织伴神经节细胞,血管周围脑膜上皮及梭形细胞,部分与脑膜瘤相关。
7. 孤立性纤维性肿瘤/血管外皮瘤(SPF/HPC):血管外皮瘤富于网状蛋白,孤立性纤维性肿瘤梭形细胞之间条索状胶原,无钙化及砂粒体,CD34的SPF弥漫阳性,而HPC阳性或阴性,EMA阴性,STAT 6核阳性。
8. 转移性癌:CK强阳性。
9. Rosai-Dorfman病:大的组织细胞S100阳性,可见伸入运动。
10. 脑膜纤维肉瘤:梭形单形性,鱼骨样结构,细胞外大量网状蛋白阳性,EMA阴性。
11. 肥胖细胞性星形细胞瘤:脑实质内浸润性生长,神经丝状背景,血管周围慢性炎症,GFAP阳性。
12. 星形细胞瘤:脑实质内,常呈囊性,血管玻璃样变,GFAP阳性,局灶EMA阳性。
13. 血管畸形:非肿瘤性脑膜上皮细胞。
14. 浅表胶质母细胞瘤/胶质肉瘤:可见GFAP阳性,肉瘤成分细胞周围大量网状蛋白,EMA阴性(除了上皮成分分化)。
预后:
关于脑膜瘤的主要预后问题包括复发率、无进展生存期和总生存期。
临床因素与预后
复发和总生存期的一个主要临床预测指标是切除范围,这受肿瘤部位、侵袭程度、与关键颅内结构的附着以及神经外科医生的手术能力。在大多数情况下,根据手术或神经放射学标准,脑膜瘤可以完全切除;但是,即使在完全切除后也可能发生复发。在一个系列研究中,20%的完全切除的良性脑膜瘤在20年内复发。CNS WHO 2级和3级脑膜瘤的复发率明显高于CNS WHO 1级脑膜瘤。死亡率也较高,特别是中枢神经系统WHO3级肿瘤的患者。
组织病理学和分级与预后
总的来说,中枢神经系统WHO分级是最有用的组织病理学复发预测指标。CNS WHO 1级脑膜瘤复发率约为7-25%,而CNS WHO 2级脑膜瘤复发率为29-52%,CNS WHO 3级脑膜瘤复发率为50-94%。然而,即使在中枢神经系统WHO 1级脑膜瘤中,一些不典型特征的存在也会增加后续进展/复发的风险。
恶性组织学特征与较短的生存时间相关。间变性脑膜瘤通常是致命的,中位生存时间为<2年到>5年,取决于切除的程度和放射治疗的使用。在一项研究中,发现中位总生存期为2.6年,5年生存率为10%,新发间变性脑膜瘤的预后优于继发性间变性脑膜瘤。有丝分裂计数高的脑膜瘤患者的总生存期明显短于有明显间变但有丝分裂计数不高的脑膜瘤患者,并且这些肿瘤患者的生存率明显低于非典型脑膜瘤患者。
分子改变与预后
脑膜瘤的一些分子特征具有预后意义。高级别脑膜瘤与更复杂的拷贝数变化和染色体异常相关。DNA甲基化模式可区分脑膜瘤亚群,包括复发风险较高的脑膜瘤亚群。有TERT启动子突变的脑膜瘤比没有TERT启动子突变的脑膜瘤有更高的恶性转化率、更短的复发时间和更低的总生存率。在一项包含677名患者的荟萃分析中,携带TERT突变的脑膜瘤患者的中位总生存期为58个月,而TERT野生型组的中位总生存期为160个月。基因内缺失的肌营养不良蛋白编码和肌营养不良相关的DMD基因在侵袭性/高级别脑膜瘤中很常见,并与较短的总生存期相关。部分具有横纹肌样特征的脑膜瘤具有BAP1失活,这些病例比其他脑膜瘤有更短的复发时间。在乳头状脑膜瘤中,常见染色质修饰因子PBRM1的突变,表明这种突变可能与侵袭性肿瘤行为有关。CDKN2A和/或CDKN2B(细胞周期调节基因)的改变在复发性和进行性脑膜瘤中经常发现,并与不良预后相关。
脑膜瘤中已经描述了几种潜在的基因突变,包括SMO、AKT1和PIK3CA的突变。其靶向治疗已在其他肿瘤类型中显示出疗效。此外,PD-L1(在其他癌症中与免疫检查点阻断反应相关)可能在高级别脑膜瘤中过度表达。免疫检查点封锁在罕见的脑膜瘤中具有高肿瘤突变负荷,这是由于错配修复装置的组分失活所致。正在进行的脑膜瘤精准医学试验将帮助我们了解这些改变对预测治疗反应的重要性。